题目内容
1.在热的稀H2SO4溶液中溶解了11.4g FeSO4,当加入50mL 0.5mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy气体逸出:□FeSO4+□KNO3+□H2SO4→K2SO4+□Fe2(SO4)3+□NxOy+□H2O
据此推算出x、y的值分别为( )
| A. | 1、2 | B. | 1、1 | C. | 2、1 | D. | 2、3 |
分析 判断化合价降低的反应物是氧化剂、化合价升高的反应物是还原剂,根据氧化剂得到的电子等于还原剂失去的电子来求x和y.
解答 解:n(FeSO4)=$\frac{11.4g}{152g/mol}$=0.075mol,KNO3的物质的量为0.05L×0.5mol•L-1=0.025mol,设NO3-与NxOy中N元素化合价差为△n,根据氧化还原反应得失电子总数相等的原则,可得关系式:0.075×1=0.025×△n,所以△n=3即NxOy中N元素化合价为+2价,则NxOy为NO,所以x=y=1;
故答案为:1;1.
点评 考查氧化还原反应的配平及电子守恒的运用,掌握氧化还原反应的理论是解题关键,基础题.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 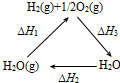 图中△H1=△H2+△H3 | |
| B. | 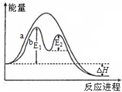 如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. |  如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 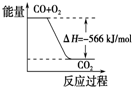 如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
9.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中发生的变化不属于氧化还原反应的是( )
| A. | 食物久置后,变质腐败产生异味 | |
| B. | 燃烧液化石油气为炒菜提供热量 | |
| C. | 食醋(CH3COOH)除去水瓶里的水垢[主要成分CaCO3和Mg(OH)2] | |
| D. | 烧菜用过的铁锅出现红棕色斑迹 |
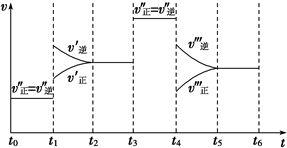
16.(1)反应N2O4(g)?2NO2(g);△H>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是K3>K1>K2..
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
20~40s内用N2O4表示的平均反应速率为0.002mol•L-1•s-1;298K时该反应的平衡转化率=75%;反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:
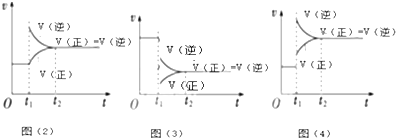
图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:

图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
6.下列反应中,反应后固体物质的质量不变的是( )
| A. | 氢气通过灼热的氧化铜 H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | |
| B. | 二氧化碳通过Na2O2粉末 2Na2O2+2CO2═2Na2CO3+O2 | |
| C. | 铝与Fe2O3发生铝热反应 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 将锌粒投入Cu(NO3)2溶液 Zn+Cu(NO3)2═Zn(NO3)2+Cu |
13.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )


| A. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| B. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| C. | 混合气体X不能使品红溶液褪色 | |
| D. | Y可以是葡萄糖 |
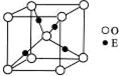 已知A、B、C、D都是短周期元素,原子序数依次增大,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种4原子的有机分子M,其原子质量比依次为1:6:8.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,原子序数依次增大,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种4原子的有机分子M,其原子质量比依次为1:6:8.E的硫酸盐溶液是制备波尔多液的原料之一.回答下列问题(用元素符号或化学式表示).