题目内容
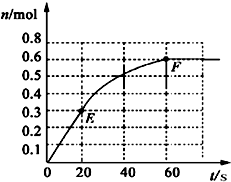 373K时,某1L密闭容器中加入1molPCl5发生如下可逆反应:
373K时,某1L密闭容器中加入1molPCl5发生如下可逆反应:PCl5 (g)
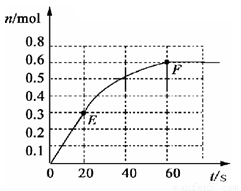
 PCl3(g)+Cl2 (g).其中物质PCl3的物质的量变化如右图所示.
PCl3(g)+Cl2 (g).其中物质PCl3的物质的量变化如右图所示.(1)前20s内PCl5(g)的平均反应速率为
0.015mol?L-1?s-1
0.015mol?L-1?s-1
(2)373K时该反应的平衡常数的值为
0.9mol?L-1
0.9mol?L-1
(3)若在此平衡体系中再加入1mol的PCl5,与原平衡比较,新平衡时PCl5的转化率
减小
减小
(填“增大”或“减小”,下同).PCl5的平衡浓度增大
增大
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,该反应的正反应为
吸热反应
吸热反应
(填“放热反应”或“吸热反应”),为增大平衡体系中Cl2的物质的量,下列措施正确的是(其它条件相同)ab
ab
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入PCl3.
分析:(1)由图象可知20s时,生成的PCl3的物质的量为0.3mol,根据v=
计算v(PCl3),再利用速率之比等于化学计量数之比计算v(PCl5);
(2)平衡常数k=
,利用三段式解题法,求出平衡时混合物各组分的物质的量,体积为1L,用物质的量代替浓度代入k=
计算;
(3)平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,积压缩压强增大平衡状态,平衡向体积减小的方向移动,即向逆反应方向移动,转化率降低,移动结果降低浓度增大趋势,平衡时浓度仍然高于原平衡;
(4)计算373K时该反应达平衡时,PCl3的平衡浓度为PCl5的倍数,与升温至473K重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍相比较,据此判断平衡移动,确定反应是吸热还是放热;增大平衡体系中Cl2的物质的量,平衡应向正反应移动.
| △c |
| △t |
(2)平衡常数k=
| c(PCl3)c(Cl2) |
| c(PCl5) |
| c(PCl3)c(Cl2) |
| c(PCl5) |
(3)平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,积压缩压强增大平衡状态,平衡向体积减小的方向移动,即向逆反应方向移动,转化率降低,移动结果降低浓度增大趋势,平衡时浓度仍然高于原平衡;
(4)计算373K时该反应达平衡时,PCl3的平衡浓度为PCl5的倍数,与升温至473K重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍相比较,据此判断平衡移动,确定反应是吸热还是放热;增大平衡体系中Cl2的物质的量,平衡应向正反应移动.
解答:解:(1)由图象可知20s时,生成的PCl3的物质的量为0.3mol,所以前20s内,PCl3(g)的平均反应速率为
v(PCl3)=
=
=0.015mol?L-1?s-1,反应速率之比等于化学计量数之比,所以v(PCl5)=v(PCl3)=0.015mol?L-1?s-1.
故答案为:0.015mol?L-1?s-1;
(2)由图象可知60s时,反应达平衡,平衡时生成的PCl3的物质的量为0.6mol,
利用三段式解题法,求出平衡时混合物各组分的物质的量
PCl5 (g) PCl3(g)+Cl2 (g),
PCl3(g)+Cl2 (g),
开始(mol):1 0 0
变化(mol):0.6 0.6 0.6
平衡(mol):0.4 0.6 0.6
所以k=
=
=0.9mol?L-1,
故答案为:0.9mol?L-1;
(3)平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,积压缩压强增大平衡状态,平衡向体积减小的方向移动,即向逆反应方向移动,转化率减小,移动结果降低浓度增大趋势,平衡时浓度仍然高于原平衡,故新平衡时PCl5的转化率减小,浓度增大.
故答案为:减小;增大;
(4)由(2)可知,373K时该反应达平衡时,PCl3的平衡浓度为PCl5的1.5倍,而升温至473K重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,倍数增加,说明平衡向正反应移动,升高温度平衡向吸热反应移动,故该反应正反应为吸热反应.
增大平衡体系中Cl2的物质的量,平衡应向正反应移动.
a、正反应为吸热反应,升高温度,平衡向正反应移动,Cl2的物质的量增大,故a正确;
b、扩大容器的体积、压强降低,平衡向体积增大方向移动,即向正反应移动,Cl2的物质的量增大,故b正确;
c、加入合适的催化剂,缩短达到平衡的时间,平衡不移动,Cl2的物质的量不变,故c错误;
d、再充入PCl3,平衡向逆反应移动,Cl2的物质的量减小,故d错误;
则ab措施正确,故答案为:吸热反应;ab.
v(PCl3)=
| ||
| △t |
| ||
| 20s |
故答案为:0.015mol?L-1?s-1;
(2)由图象可知60s时,反应达平衡,平衡时生成的PCl3的物质的量为0.6mol,
利用三段式解题法,求出平衡时混合物各组分的物质的量
PCl5 (g)
 PCl3(g)+Cl2 (g),
PCl3(g)+Cl2 (g),开始(mol):1 0 0
变化(mol):0.6 0.6 0.6
平衡(mol):0.4 0.6 0.6
所以k=
| c(PCl3)c(Cl2) |
| c(PCl5) |
| 0.6×0.6 |
| 0.4 |
故答案为:0.9mol?L-1;
(3)平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,积压缩压强增大平衡状态,平衡向体积减小的方向移动,即向逆反应方向移动,转化率减小,移动结果降低浓度增大趋势,平衡时浓度仍然高于原平衡,故新平衡时PCl5的转化率减小,浓度增大.
故答案为:减小;增大;
(4)由(2)可知,373K时该反应达平衡时,PCl3的平衡浓度为PCl5的1.5倍,而升温至473K重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,倍数增加,说明平衡向正反应移动,升高温度平衡向吸热反应移动,故该反应正反应为吸热反应.
增大平衡体系中Cl2的物质的量,平衡应向正反应移动.
a、正反应为吸热反应,升高温度,平衡向正反应移动,Cl2的物质的量增大,故a正确;
b、扩大容器的体积、压强降低,平衡向体积增大方向移动,即向正反应移动,Cl2的物质的量增大,故b正确;
c、加入合适的催化剂,缩短达到平衡的时间,平衡不移动,Cl2的物质的量不变,故c错误;
d、再充入PCl3,平衡向逆反应移动,Cl2的物质的量减小,故d错误;
则ab措施正确,故答案为:吸热反应;ab.
点评:本题考查化学平衡及平衡常数的有计算、等效平衡思想利用,难度中等,注意(3)中等效平衡思想,把一个平衡的建立设计成多步进行,使问题简单化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.
(2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.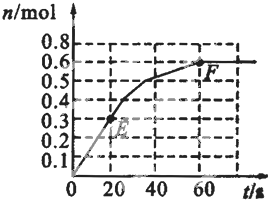 373K时,某1L密闭容器中发生如下可逆反应:A (g)?2B (g).其中物质B的物质的量变化如图所示
373K时,某1L密闭容器中发生如下可逆反应:A (g)?2B (g).其中物质B的物质的量变化如图所示 N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。

 d.再充入N2
d.再充入N2 其中物质PCl3的物质的量变化如右图所示。
其中物质PCl3的物质的量变化如右图所示。