题目内容
19.二氧化硫是硫的重要化合物,在生产,生活中有广泛应用,探究二氧化硫的制取和性质都有非常重要的意义.(1)工业上用黄铁矿(FeS,其中S元素为-1价)在高温下和氧气反应制备SO2.
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
该反应中被氧化的元素是Fe、S(填元素符号).当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为11.2L;
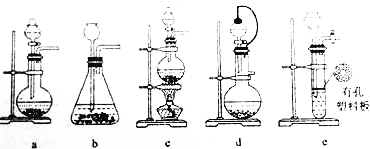
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,如图可选用的发生装置是a(填写字母);
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠19.8g(保留一位小数).
分析 (1)4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2中,Fe、S元素的化合价升高,O元素的化合价降低;
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,为固体与液体反应不加热装置,能控制反应速度,利用分液漏斗控制液体的加入;
②由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量;设没有变质的亚硫酸钠为100g,根据变质的质量计算出变质后溶液中亚硫酸钠的质量分数,再计算出需要变质后的亚硫酸钠的质量.
解答 解:(1)4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2中,Fe、S元素的化合价升高,O元素的化合价降低,则该反应中被氧化的元素是Fe、S,该反应转移44e-,该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为5.5mol×$\frac{8}{44}$×22.4L/mol=11.2L,
故答案为:Fe、S;11.2;
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,为固体与液体反应不加热装置,能控制反应速度,利用分液漏斗控制液体的加入,只有a符合,
故答案为:a;
②由硫守恒可得:Na2SO3~SO2,因此需称取亚硫酸钠的质量为:m(Na2SO3)=126g•mol-1×$\frac{3.36L}{22.4L/mol}$=18.9g;
设没有变质的亚硫酸钠为100g,则有4g亚硫酸钠被氧化成硫酸钠,4g亚硫酸氧化为硫酸钠后质量变为:4g×$\frac{142}{126}$=4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为$\frac{100g-4g}{100g-4g+4.5g}$×100%=95.5%,
因此称取变质后样品的质量应为$\frac{18.9g}{95.5%}$=19.8g,
故答案为:19.8.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | B、C、D形成的简单离子半径大小顺序Cm+>Dn+>Bx-(m+、n+、x-表示所带电荷) | |
| B. | A、B、E气态氢化物稳定性为E>A>B | |
| C. | C和D的最高价氧化物对应的水化物之间可以发生反应 | |
| D. | E单质是制备太阳能电池的重要材料是因为E的单质导电性强 |

| A. | 1 mol该化合物最多可与2 mol H2反应 | |
| B. | 该化合物能与乳酸发生酯化反应 | |
| C. | 该化合物能与氢氧化钠溶液、溴水反应 | |
| D. | 该化合物的同分异构体可能为芳香族化合物 |
①mg该氯原子的物质的量一定是$\frac{m}{a{N}_{A}}$mol
②该氯原子的摩尔质量是aNAg•mol-1
③ag该氯原子所含的质子数是17NA.
| A. | ①③ | B. | ②③ | C. | ①② | D. | ①②③ |
| A. | 氢氧化钠的电子式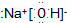 | |
| B. | 质子数为29、中子数为35的铜原子${:}_{29}^{35}$Cu | |
| C. | 氯离子的结构示意图: | |
| D. | 对苯二酚的结构简式: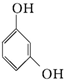 |
| A. | 铁件表面镀铬时,铁件与外电源正极相连 | |
| B. | 反应CaO(s)+3C(s)═CaC2(s)+CO(g)在高温下能自发进行,则该反应的△H<0 | |
| C. | 用湿润的pH试纸测定0.1 mol•L-1的Na2CO3溶液的pH,其pH将偏大 | |
| D. | 已知(CH3CO)2O与水反应可生成乙酸(△H<0),向0.1 mol•L-1的乙酸溶液中加入少量(CH3CO)2O,溶液的pH和乙酸的电离程度均减小 |