题目内容
【题目】如图是一种新型高温可充电电池(电池活性物质为Na和S),则下列说法中正确的是
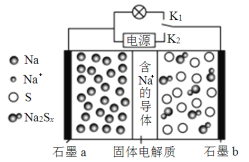
A.放电时,Na+由石墨b向石墨a迁移
B.充电时石墨b与外接电源负极相连
C.可将装置中的固体电解质改成NaCl溶液
D.放电时石墨b上发生的反应为:2Na++xS+2e![]() Na2Sx
Na2Sx
【答案】D
【解析】本题考查化学电源。由装置图可知,石墨a极活性物质为Na,石墨b极活性物质为S,则原电池放电时,石墨电极a为负极,石墨电极b为正极,在原电池中,阳离子移向正极,所以放电时,Na+从负极石墨a向正极石墨b方向迁移,故A错;充电时,电源的负极与原电池的负极相连,电源的正极与原电池的正极相连,所以充电时石墨a与外接电源负极相连,故B错;由于钠单质会与水反应,所以固体电解质不能改成NaCl溶液,故C错;放电时,石墨b为正极,S得电子与钠离子结合为Na2Sx,电极反应式为2Na++xS+2e![]() Na2Sx,故D正确。
Na2Sx,故D正确。

练习册系列答案
相关题目
【题目】下表是3种物质的溶解度(20℃),下列说法中不正确的是
物 质 | MgCl2 | Mg(OH)2 | MgCO3 |
溶解度(g/100g) | 74 | 0.00084 | 0.01 |
A. 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
B. 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH溶液
C. 已知MgCO3的Ksp=6.82×10-6mol2/L2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)×c(CO32-)=6.82×10-6mol2/L2
D. 用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:
Mg2++2HCO3-+2Ca2++4OH-===2CaCO3↓+Mg(OH)2↓+2H2O
