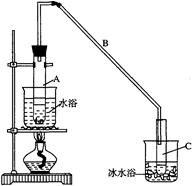
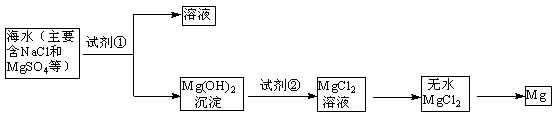
题目内容
除去下列物质中的杂质,所用试剂和方法不正确的是 ( )
| | 物质 | 杂质 | 除杂质所用试剂和方法 |
| A | KCl溶液 | I2 | CCl4,萃取 |
| B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
| C | Cu | CuO[ | 盐酸,过滤 |
| D | CaCO3 | CaO | 盐酸,过滤 |
D
试题分析:A选项中,碘易溶于CCl4,且CCl4与KCl不容。正确。B选项硝酸钡与硫酸钾发生反应,得到硫酸钡沉淀,可除杂。正确。C选项加入盐酸后,氧化铜与盐酸发生反应后得到氯化铜溶于水,单质铜不与盐酸反应,过滤后得到铜单质。正确。D选项错误,加入盐酸后,原物质碳酸钙也与盐酸反应,原物质被消耗。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl- 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42- 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+ 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-