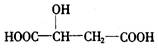题目内容
在催化剂的作用下,乙炔可被氧化为乙二醛,进一步氧化,乙二醛又转化为乙二酸。某工厂生产乙二酸,每日可消耗乙炔气20.0 m3(已折算到标准状况),为监测产品质量,须不断抽样分析。假设某化验员抽取了10.00 g乙二酸产品,然后用6.00 mol·L-1的KOH(aq)进行滴定,达到滴定终点时消耗了碱液36.30 mL。求该工业乙二酸的纯度(已知乙二酸是强酸)。
98.0%。
乙炔气的日消耗量是干扰因素,与解本题无关。由题意得:
HOOC—COOH+2KOH KOOC—COOK+2H2O
KOOC—COOK+2H2O
90.0 g 2.00 mol
m(乙二酸) 6.00 mol·L-1×0.036 30 L
m(乙二酸)=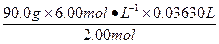 ="9.80" g
="9.80" g
ω(乙二酸)=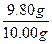 ×100%=98.0%
×100%=98.0%
HOOC—COOH+2KOH
 KOOC—COOK+2H2O
KOOC—COOK+2H2O90.0 g 2.00 mol
m(乙二酸) 6.00 mol·L-1×0.036 30 L
m(乙二酸)=
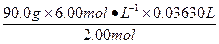 ="9.80" g
="9.80" gω(乙二酸)=
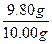 ×100%=98.0%
×100%=98.0%
练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
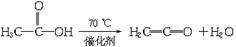
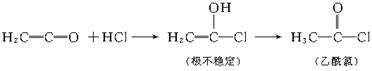
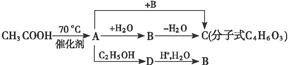
 D的化学方程式_______________________________________________。
D的化学方程式_______________________________________________。