��Ŀ����
����Ŀ��������ȼ�����ɽ�������̼��ȼ�ϡ��ش���������:
��1��CO2�ĵ���ʽΪ________________.
��2���������������ʵ���ҳɹ����ñ���ɶ�״���ϵ�����̼������ͭ��ͨ��ʱ�ɽ��������������̼��ˮֱ��ת��Ϊ�ƾ����÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��
��3��Zn/ZnO�Ȼ�ѧѭ����ԭCO2��CO��ԭ������ͼ��
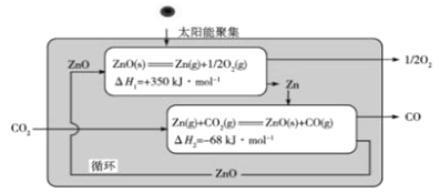
�ٴ�ѭ���������������Ҫת����ʽ��________________________________��
�ڷ�Ӧ![]() ��H= _______________kJ��mol-1��
��H= _______________kJ��mol-1��
��4������CO2��H2��ֱ�Ӻϳɶ����ѣ� ![]() ����
����![]() ʱ��ʵ����CO2��ƽ��ת�������¶ȼ�ѹǿ�仯��ͼ1��ʾ�������ѵIJ������¶ȼ�ѹǿ�仯��ͼ2��ʾ��
ʱ��ʵ����CO2��ƽ��ת�������¶ȼ�ѹǿ�仯��ͼ1��ʾ�������ѵIJ������¶ȼ�ѹǿ�仯��ͼ2��ʾ��
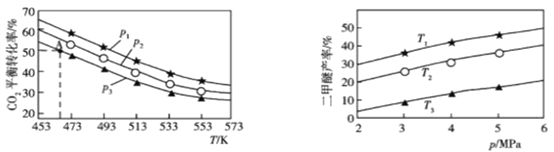
ͼ1 ͼ2
�ٸ÷�Ӧ�ġ�H________0����������������������
��ͼ1��ѹǿ��p���ɴ�С��˳��Ϊ______________________________��
��ͼ2���¶ȣ�T���ɴ�С��˳��Ϊ______________________________��
������1L�ܱ������г���0.2mol CO2��0.6mol H2��ƽ��ת���ʶ�Ӧͼ1��A�㣬���ڴ��¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ________________________��������������
���𰸡� ![]()
 ̫��������ѧ�� +564 ��
̫��������ѧ�� +564 �� ![]()
![]() 23
23
����������1��CO2�ǹ��ۻ�������̼ԭ����4�����ӷֱ����ԭ���γ����Թ��õ��Ӷ�������ʽΪ��![]() ��
��
��2������֪������ȼ�����ɽ�������̼��ȼ�ϣ���Ӧ��Ϊ������̼��ˮ������̼������ͭ������������Ϊͨ�磬������Ϊ�Ҵ�����������ѧ����ʽΪ��2CO2+3H2O![]() C2H5OH+3O2��
C2H5OH+3O2��
��3���ٸ��ݸ�˹���ɣ���ͼ�е�������Ӧ��ӵã�CO2(g)=CO(g)+ ![]() O2(g) ��H=+282kJ��mol-1�����Ը÷�ӦΪ���������ķ�Ӧ���ʴ�ѭ���������������Ҫת����ʽ�ǣ�̫��������ѧ�ܡ����ɢ��з�Ӧ�ɵã�2CO2(g)=2CO(g)+O2(g) ��H=+564kJ��mol-1��
O2(g) ��H=+282kJ��mol-1�����Ը÷�ӦΪ���������ķ�Ӧ���ʴ�ѭ���������������Ҫת����ʽ�ǣ�̫��������ѧ�ܡ����ɢ��з�Ӧ�ɵã�2CO2(g)=2CO(g)+O2(g) ��H=+564kJ��mol-1��
��4������ͼ1�ɵã���һѹǿ�£��¶�Խ�ߣ�CO2ת����ԽС����������ӦΪ���ȷ�Ӧ����H��0�����ɻ�ѧ����ʽ�ɵã�����Ӧ�������������С�ķ�Ӧ��ѹǿԽ��CO2 ת����Խ����P1>P2>P3���۸÷�Ӧ����Ϊ���ȷ�Ӧ�������¶�Խ�ߣ������ѵIJ���Խ�ͣ���ͼ2�ɵã���ͬѹǿ��T1�¶�ʱ�����ѵIJ�����ߣ�T3�¶�ʱ�����ѵIJ�����ͣ�����T3��T2��T1������ͼ1��A��CO2��ƽ��ת����Ϊ50%������֪��������ʽ���ã�
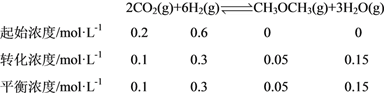
����K=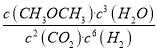 ��
��![]() ��23��������������
��23��������������

 ��У����ϵ�д�
��У����ϵ�д�