题目内容
【题目】如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.
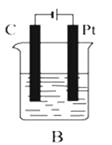

(1)A、B、C三个装置中属于原电池的是属于电解池的是 .
(2)A池中Zn是极,Cu极发生(填“氧化”或“还原”)反应,电极反应为 . 反应过程溶液中c(Cu2+)(填“变大”“变小”或“不变”).
(3)B池中C棒是极,一段时间后的现象为 , 电极反应为 . B 池中的总反应为 .
(4)C池在化学反应中发生的能量转化形式是 .
【答案】
(1)A;BC
(2)负;还原;Cu2++2e﹣=Cu;变小
(3)阴极;碳棒表面有红色物质生成;Cu2++2e﹣=Cu;CuCl2 ![]() Cu+Cl2↑
Cu+Cl2↑
(4)电能转化为化学能
【解析】(1)A没有外接电源,属于原电池,BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池; B C;(2)铜、锌、氯化铜原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn﹣2e﹣=Zn2+ ,
铜作正极,正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e﹣=Cu,反应过程溶液中c(Cu2+) 减小;(3)该装置是电解池,且阳极是惰性电极,C连接电源负极,所以是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e﹣=Cu,可观察到碳棒表面有红色物质生成,铂连接电源正极,所以铂在阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl﹣﹣2e﹣=Cl2↑,总反应为CuCl2![]() Cu+Cl2↑;(4)该装置是电解池,电能转化为化学能.
Cu+Cl2↑;(4)该装置是电解池,电能转化为化学能.

练习册系列答案
相关题目



