题目内容
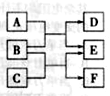
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )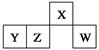
| A.原子半径:rW>rZ>rY>rX |
| B.含Y元素的盐溶液一定显酸性 |
| C.最简单气态氢化物的热稳定性:Z>W |
| D.X与氢元素组成的化合物XH5与水反应可产生两种气体 |
D
解析试题分析:根据“短周期元素W原子的最外层电子数是最内层电子数的3倍”和四种元素的位置关系图说明W元素为硫元素,从而确定X为氮元素,Y为铝元素,Z为硅元素;A项原子半径大小正确关系为rY>rZ>rW>rX,错误;B项铝元素形成的偏铝酸盐水解能使溶液显碱性,错误;C项硫元素的非金属性比硅元素强,即氢化物的稳定性为H2S>SiH4,错误;D项NH5即为NH4H,与反应可生成NH3和H2,正确。
考点:元素周期表,原子半径大小比较、盐的水解,气态氢化物的稳定性(元素的非金属性),氧化还原反应(归中反应)。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
O、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,W是大气中含量最高的元素,由此可知 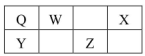
A.Q的一种核素中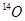 的质子数和中子数相等 的质子数和中子数相等 |
| B.X的最高正化合价与最低负化合价的绝对值之差为6 |
| C.Y是常见的半导体材料 |
| D.Z的氧化物的水化物是强酸 |
与氢氧根具有相同的质子数和电子数的微粒是
| A.CH4 | B.NH4+ | C.NH2- | D.Cl- |
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A.Y和Z可以组成一种Y和Z的质量比为7∶8的化合物 |
| B.X、Y、Z可以组成一种盐 |
| C.X和Z可以组成原子个数比分别为1∶1和2∶1常温下呈液态的两种化合物 |
| D.由X、Y、Z三种元素中的任意两种组成的10电子微粒只有2种 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是( )
| A.离子半径:C>D>B>A | B.原子序数:d>c>b>a |
| C.原子半径:A>B>C>D | D.单质的还原性:A>B>D>C |
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为 ( )
| A.X+32 | B.X+4 | C.X+8 | D.X+18 |
在一定条件下,RO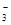 与R-可发生反应:RO
与R-可发生反应:RO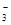 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第ⅤA族 |
B.RO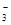 中的R只能被还原 中的R只能被还原 |
| C.CaR2是离子化合物,阴阳离子电子层结构相同,且既含有离子键,又含有共价键 |
| D.3 mol R2中,氧化产物与还原产物的质量比为5︰1 |
已知X、Y、Z、W是原子序数依次增大的短周期元素,这些元素的其他信息如下表。下列说法正确的是
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
B.Y的氢化物比W的氢化物稳定
C.Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物
D.X在氧气中加热反应生成X2O2
 )。它们满足如图转化关系,则下列说法正确的是( )
)。它们满足如图转化关系,则下列说法正确的是( )