题目内容
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)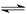 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g)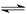 CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g)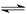 CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+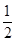 O2(g)
O2(g) 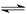 CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)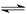 CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有 。
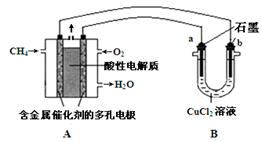
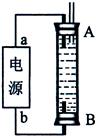
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是 极。

Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)
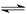 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①2CH3OH(g)
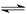 CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②CO(g)+H2O(g)
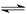 CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③(1)甲烷氧化可制得合成气,反应如下:CH4(g)+
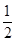 O2(g)
O2(g) 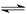 CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。(2)催化反应室中总反应3CO(g)+3H2(g)
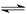 CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。(3)上述反应中,可以循环使用的物质有 。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是 极。

Ⅰ.(1)自发 (2)-246.1 kJ/mol >
(3)CO、H2、甲醇和水
Ⅱ.正
(3)CO、H2、甲醇和水
Ⅱ.正
Ⅰ.(1)反应后气体的物质的量增大,混乱度增加,熵增大,ΔS>0,由复合判据得该反应能自发进行。
(2)反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)可利用题给的三个反应,将①×2+②+③得到,则ΔH=-90.7 kJ/mol×2+(-23.5 kJ/mol)+(-41.2 kJ/mol)=-246.1 kJ/mol;因为催化反应室中的温度低于830℃,温度降低,反应③的平衡向正反应方向移动,故K>1.0。
CH3OCH3(g)+CO2(g)可利用题给的三个反应,将①×2+②+③得到,则ΔH=-90.7 kJ/mol×2+(-23.5 kJ/mol)+(-41.2 kJ/mol)=-246.1 kJ/mol;因为催化反应室中的温度低于830℃,温度降低,反应③的平衡向正反应方向移动,故K>1.0。
(3)从流程图中可以看出排出的物质CO、H2、甲醇和水在反应①、②、③中可以作为反应物,故均可以循环利用。
Ⅱ.燃料电池中通入O2的一极发生还原反应,即b电极是正极。
(2)反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g)可利用题给的三个反应,将①×2+②+③得到,则ΔH=-90.7 kJ/mol×2+(-23.5 kJ/mol)+(-41.2 kJ/mol)=-246.1 kJ/mol;因为催化反应室中的温度低于830℃,温度降低,反应③的平衡向正反应方向移动,故K>1.0。
CH3OCH3(g)+CO2(g)可利用题给的三个反应,将①×2+②+③得到,则ΔH=-90.7 kJ/mol×2+(-23.5 kJ/mol)+(-41.2 kJ/mol)=-246.1 kJ/mol;因为催化反应室中的温度低于830℃,温度降低,反应③的平衡向正反应方向移动,故K>1.0。(3)从流程图中可以看出排出的物质CO、H2、甲醇和水在反应①、②、③中可以作为反应物,故均可以循环利用。
Ⅱ.燃料电池中通入O2的一极发生还原反应,即b电极是正极。

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。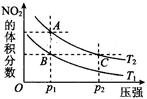
 CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L
CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L 则Q1和Q2的关系为( )
则Q1和Q2的关系为( )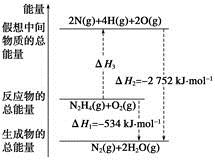
 CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1, CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。 CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: