题目内容
【题目】不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。请完成以下有关物质结构的问题:
(1)写出Fe2+的最高能层的电子排布式:________________。
(2)[Cr(H2O)4Cl2] Cl·2H2O中Cr 的配位数为________________;
已知CrO5中Cr为+6价,则CrO5的结构式为________。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,推测Ni(CO)n的晶体类型为_______;己知该物质的中心原子价电子数与配体提供电子总数之和为18,则n=__________;与Ni(CO)n中配体互为等电子体的阴离子化学式为________________。
(4)金刚砂(SiC)结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得到金刚砂(SiC)结构。SiC是_________晶体,键角是_________;在SiC中,如果以一个硅原子为中心,则与硅原子次近的第二层有________个硅原子。
(5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。CuH的晶体结构如下图所示,若CuH的密度为d g ·cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为______cm(用含d和Na的式子表示)。

【答案】 3s23p63d6 6 ![]() 分子晶体 4 CN- 原子 109°28′ 12
分子晶体 4 CN- 原子 109°28′ 12 ![]()
【解析】(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6,所以Fe2+的最高能层的电子排布式为3s23p63d6。(2)[Cr(H2O)4Cl2] Cl·2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为![]() 。(3)Ni(CO)n为无色挥发性液体,什么熔沸点较低,形成的晶体类型是分子晶体;Ni(CO)n中Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,解得n=4。原子数和价电子数分别都相等的互为等电子体,则与Ni(CO)n中配体互为等电子体的阴离子化学式为CN-。(4)金刚砂(SiC)结构与金刚石结构相似,金刚石是原子晶体,则金刚砂是原子晶体,键角是109.28°;距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,这12个Si原子平均分布在一个球面上,即与硅原子次近的第二层有12个硅原子。(5)该晶胞中含有4个H原子,铜原子个数=1/8×8+6×1/2=4,所以4个氢原子与4个铜原子的质量之和(64+1)/NA,设该晶胞的边长为a,晶胞的体积为a3,所以密度ρ=m/V=
。(3)Ni(CO)n为无色挥发性液体,什么熔沸点较低,形成的晶体类型是分子晶体;Ni(CO)n中Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,解得n=4。原子数和价电子数分别都相等的互为等电子体,则与Ni(CO)n中配体互为等电子体的阴离子化学式为CN-。(4)金刚砂(SiC)结构与金刚石结构相似,金刚石是原子晶体,则金刚砂是原子晶体,键角是109.28°;距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,这12个Si原子平均分布在一个球面上,即与硅原子次近的第二层有12个硅原子。(5)该晶胞中含有4个H原子,铜原子个数=1/8×8+6×1/2=4,所以4个氢原子与4个铜原子的质量之和(64+1)/NA,设该晶胞的边长为a,晶胞的体积为a3,所以密度ρ=m/V=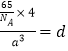 ,则a=
,则a=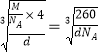 。
。