题目内容
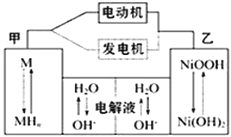
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示,其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是
A. 发电机充电时,阴极附近pH降低
B. 电动机工作时溶液中OH﹣向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
【答案】A
【解析】
MH为吸附氢原子的储氢合金,M为储氢合金,根据装置图,甲为负极,电极反应式为MH-e-+OH-=M+H2O,乙电极反应为正极,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,然后进行分析即可;
MH为吸附氢原子的储氢合金,M为储氢合金,根据装置图,甲为负极,电极反应式为MH-e-+OH-=M+H2O,乙电极反应为正极,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,
A、充电时,电池的正极接电源的正极,电池的负极接电源的负极,即阴极反应式为M+H2O+e-=MH+OH-,阴极附近pH增大,故A说法错误;
B、电动机工作,该装置为电池,根据原电池工作原理,OH-向负极移动,即向甲移动,故B说法正确;
C、根据上述分析,正极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,故C说法正确;
D、电极总反应式为MH+NiOOH![]() M+Ni(OH)2,故D说法正确;
M+Ni(OH)2,故D说法正确;

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目