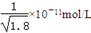题目内容
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-)。下列说法正确的是
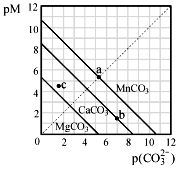

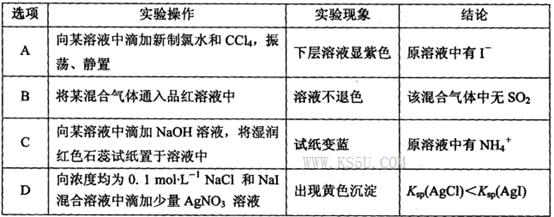
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |
B
试题分析:A、pM相等时,图线中p(CO32-)数值越大,CO32-实际浓度越小,溶度积常数越小,所以根据图像可知MgCO3、CaCO3、MnCO3的Ksp依次减小,故A错误;B、a点可表示MnCO3的饱和溶液,pM=p(CO32-),所以c(Mn2+)=c(CO32-),故B正确;C、b点可表示CaCO3的饱和溶液,pM<p(CO32-),所以c(Ca2+)>c(CO32-),故C错误;D、c点不在曲线上,则c点可表示MgCO3 的不饱和溶液。pM数值越大,金属阳离子的实际浓度越小。由于pM>p(CO32-),所以c(Mg2+)<c(CO32-),故D不正确,答案选B。

练习册系列答案
相关题目