题目内容
4.有下列两组命题| A组 | B组 |
| Ⅰ.H2O分子间存在氢键,H2S则无 | ①H2O比H2S稳定 |
| Ⅱ.晶格能NaI比NaCl小 | ②NaCl比NaI熔点高 |
| Ⅲ.晶体类型不同 | ③N2分子比磷的单质稳定 |
| Ⅳ.元素第一电离能大小与原子外围电子排布有关,不一定像电负性随原子序数递增而增大 | ④同周期元素第一电离能大的,电负性不一定大 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
分析 A.氢键只影响物质的物理性质,不影响物质的稳定性;
B.离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强;
C.氮气与磷都是分子晶体;
D.同周期元素从左到右元素的电负性逐渐增大,第一电离能逐渐增大但ⅤA族大于ⅥA族元素.
解答 解:A.H2O分子间存在氢键,H2S则无,但是氢键不影响物质的稳定性,所以B命题错误,故A错误;
B.氯离子半径小于碘离子所以晶格能NaI比NaCl小,离子键越强,熔沸点越高,所以NaCl比NaI熔点高,故B正确;
C.氮气与磷都是分子晶体,二者晶体类型相同,故C错误;
D.元素第一电离能大小与原子外围电子排布有关,同周期元素从左到右元素的电负性逐渐增大,第一电离能逐渐增大但ⅤA族大于ⅥA族元素,故D正确;
故选:BD.
点评 本题考查了氢键对物质性质的影响、元素电离能、电负性大小规律,题目难度中等,注意氢键只影响物质的物理性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.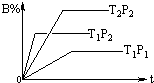 已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
 已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>P△H<0 | B. | T1>T2 P1<P2 m+n<P△H>0 | ||
| C. | T1<T2 P1<P2 m+n<P△H<0 | D. | T1>T2 P1<P2 m+n>P△H>0 |
15.生产、生活离不开化学,下列说法不正确的是( )
| A. | 不需要通过化学反应就能从海水中获得食盐和淡水 | |
| B. | 燃料电池的燃料都在负极发生氧化反应 | |
| C. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| D. | 工业上常用高纯硅制造光导纤维 |
12.一定量某物质的溶液,其质量分数为0.2A,当加入等体积的水稀释后,其质量分数小于0.1A,则该溶液的密度( )
| A. | 大于水的密度 | B. | 小于水的密度 | C. | 等于水的密度 | D. | 无法确定 |
9.下列各离子组的叙述正确的是( )
| A. | 在强酸性条件下Na+、IO-、K+、可以大量共存 | |
| B. | 在强碱性条件下K+、AlO2-、Na+、NO3-可以大量共存 | |
| C. | 在水溶液中H+、NH4+、SiO32-、Cl-不能大量共存 | |
| D. | 在强酸性条件下NH4+、K+、SO32-、S2-可以大量共存 |
16.用NA代表阿伏加德罗常数,下列表述正确的是( )
| A. | 1L 0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 标况下,22.4L辛烷完全燃烧生成二氧化碳分子为8NA | |
| C. | 1mol Na2O和1mol Na2O2晶体中离子总数均为3NA | |
| D. | 1mol羟基中电子数为10 NA |




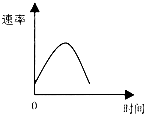 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )