题目内容
3.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液 |
| ② | 向新制得到的Na2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①烧杯,②酒精灯,③试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等
(3)写出实验②中的实验现象和化学方程式
现象:出现淡黄色沉淀
化学方程式Cl2+Na2S=S↓+2NaCl
(4)实验结论同周期元素性质自左向右金属性越来越弱,非金属性越来越强.
分析 (1)由实验步骤可知,比较Na、Mg、Al的金属性强弱,S、Cl的非金属性强弱,实验目的是研究同周期元素性质递变规律;
(2)步骤①中需要用沸水,应用酒精灯加热,用烧杯盛放水,且钠与水的反应应在烧杯中进行,而Mg、Al与盐酸反应,硫化钠溶液与氯水反应宜在试管中进行,且提供的仪器中有试管夹;
(3)氯水与硫化钠反应生成S与NaCl,S为淡黄色且不溶;
(4)根据反应现象判断金属性、非金属性强弱规律.
解答 解:(1)由实验步骤可知,比较Na、Mg、Al的金属性强弱,S、Cl的非金属性强弱,实验目的是研究同周期元素性质递变规律,故答案为:同周期;
(2)步骤①中需要用沸水,应用酒精灯加热,用烧杯盛放水,且钠与水的反应应在烧杯中进行,而Mg、Al与盐酸反应,硫化钠溶液与氯水反应宜在试管中进行,且提供的仪器中有试管夹,
故答案为:烧杯、酒精灯、试管;
(3)氯水与硫化钠反应生成S与NaCl,反应方程式为:Cl2+Na2S=S↓+2NaCl,现象:出现淡黄色沉淀,
故答案为:出现淡黄色沉淀;Cl2+Na2S=S↓+2NaCl;
(4)①因镁条能和热水反应生成氢氧化镁和氢气,氢氧化镁是碱,遇酚酞变红,所以会看到镁条表面有大量气泡,溶液变成红色;
②因氯气能将硫离子氧化为硫:Na2S+Cl2=2NaCl+S↓,硫不溶于水,产生浅黄色沉淀,说明Cl非金属性比S的强;
③钠与冷水剧烈反应生成氢气和氢氧化钠,氢氧化钠遇酚酞变红,颜色较①中更深,说明金属性Na>Mg,
④因镁为活泼金属,与盐酸发生置换反应,所以剧烈反应,迅速产生大量无色气体;
⑤铝能与盐酸反应,较镁不活泼,所以反应不十分剧烈,对比④⑤可知金属性Mg>Al,
以此可得出:同周期元素性质自左向右金属性越来越弱,非金属性越来越强.
故答案为:同周期元素性质自左向右金属性越来越弱,非金属性越来越强.
点评 本题考查化学实验方案、元素周期律,是一道同周期元素性质的递变规律的探究题,培养了学生分析和解决问题的能力,题目难度中等.

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案| A. | $\frac{b}{a}$g | B. | $\frac{100b}{(a+b)g}$ | C. | $\frac{100b}{a}$g | D. | 无法计算 |
| A. | 实验室蒸馏石油的实验中,冷凝管的水流方向是上方进水下方出水 | |
| B. | 石油裂解不是生产乙烯的主要方法 | |
| C. | 油脂和石油是同一类有机物 | |
| D. | 从石油分馏得到的汽油,主要由含5-12个碳原子的烷烃组成 |
| A. | 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 | |
| B. | 将煤进行“气化”和“液化”处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
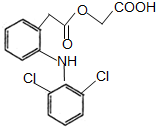 醋氯芬酸是新合成的一种抗炎、解热、镇痛的口服药物,结构简式如图所示,下列有关它的说法不正确的是( )
醋氯芬酸是新合成的一种抗炎、解热、镇痛的口服药物,结构简式如图所示,下列有关它的说法不正确的是( )| A. | 该药品的分子式是C16H13O4NCl2 | |
| B. | 1mol有机物与NaOH溶液反应最多消耗2mol氢氧化钠 | |
| C. | 1mol该有机物与氢气反应最多消耗6mol氢气 | |
| D. | 能与NaHCO3发生反应生成气体 |
| A. |  | B. |  | C. |  | D. |  |