题目内容
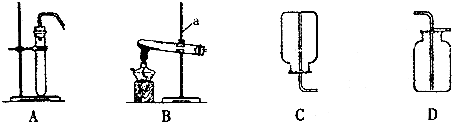
6.下列实验操作一定要用到玻璃棒的是( )①过滤
②蒸发
③一定物质的量浓度溶液的配制.
| A. | ①②③ | B. | 只有① | C. | 只有①② | D. | 只有①③ |
分析 过滤需要玻璃棒引流,蒸发利用玻璃棒搅拌,配制溶液转移液体需要玻璃棒,以此来解答.
解答 解:①过滤,使用玻璃棒引流;
②蒸发,使用玻璃棒搅拌;
③一定物质的量浓度溶液的配制,需要玻璃棒转移液体,
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离提纯实验操作为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.2011年3月11日的日本大地震造成日本福岛核电站出现严重事故,由核反应堆泄漏出的${\;}_{53}^{131}$I和罗${\;}_{55}^{137}$Cs引起了全世界的关注,其中${\;}_{55}^{137}$Cs原子核内的中子数为( )
| A. | 82 | B. | 55 | C. | 137 | D. | 192 |
18.下列物质的转化,在给定条件下均能通过一步反应实现的是( )
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | NaCl(饱和)$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Fe$→_{点燃}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| D. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 中性溶液:Fe3+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| B. | 1.0mol•L-1的FeCl3溶液:H+、S2-、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生氢气的溶液:K+、Na+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ |
11.请按要求完成下列各小题:
(1)用CO2来生产燃料甲醇的反应原理为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+3b-c-3a-3e)kJ/mol(用相应字母表示).写出上述反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;若只加压,则平衡常数K不变(填“增大”“减小”或“不变”).
(2)在溶液中,NaH2PO4和Na3PO4等物质的量混合恰好完全反应,该反应的离子方程式为H2PO4-+PO43-=2HPO42-,
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=10.在此温度下,将0.01mol•L-1的H2SO4溶液VaL与P
H=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=15:2.
(4)在25℃时,将cmol•L-1的醋酸溶液与bmol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{b×1{0}^{-7}}{c-b}$.
(5)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-2(数据顺序以打乱),已知三种酸和它们的盐之间能发生以下反应:HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC.则三种酸对应的电离平衡常数分别为(请用序号填空)
(1)用CO2来生产燃料甲醇的反应原理为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kj•mol-1 | a | b | c | d | e |
(2)在溶液中,NaH2PO4和Na3PO4等物质的量混合恰好完全反应,该反应的离子方程式为H2PO4-+PO43-=2HPO42-,
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=10.在此温度下,将0.01mol•L-1的H2SO4溶液VaL与P
H=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=15:2.
(4)在25℃时,将cmol•L-1的醋酸溶液与bmol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{b×1{0}^{-7}}{c-b}$.
(5)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-2(数据顺序以打乱),已知三种酸和它们的盐之间能发生以下反应:HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC.则三种酸对应的电离平衡常数分别为(请用序号填空)
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
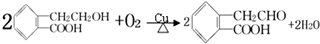

 +Br2→
+Br2→ .
.