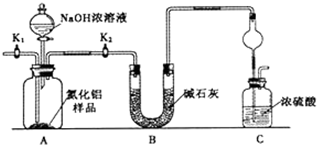
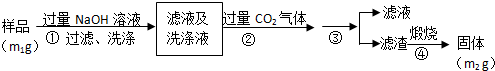
题目内容
19.下列各组离子在溶液中能大量共存的有( )| A. | K+、Na+、HCO3-、OH- | B. | Fe3+、Cu2+、H+、NO3- | ||
| C. | Na+、H+、Cl-、AlO2- | D. | H+、Cu2+、Cl-、SO42- |
分析 根据离子之间不能结合生成水、气体、沉淀,不能发生氧化还原反应,不能结合生成络离子等,则离子能大量共存,以此来解答.
解答 解;A.HCO3-、OH-反应生成CO32-和水而不能大量共存,故A错误;
B.离子之间不发生任何反应,可大量共存,故B正确;
C.H+、AlO2-反应生成氢氧化铝沉淀,不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选BD.
点评 本题考查离子的共存问题,为高频考点,侧重于学生的分析能力的考查,注意把握常见离子的性质以及反应类型的判断,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
9.碘酒是一种常用的外用消毒药,关于它的消毒原理说法正确的是( )
| A. | 溶解细菌 | B. | 使细菌蛋白质变性 | ||
| C. | 使细菌缺氧而死 | D. | 使细菌缺水而死 |
10.某原电池构造如图所示.下列有关叙述正确的是( )


| A. | 在外电路中,电子由铜电极流向锌电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g | |
| D. | Zn做正极 |
7.要使含有Ba2+、Al3+、Cu2+、Mg2+、Ag+等离子的溶液中的各离子逐一形成沉淀析出,下列所选择的试剂及加入试剂的顺序正确的是( )
| A. | H2SO4-HCl-H2S-NaOH-CO2 | B. | HCl-H2SO4-Na2S-NaOH-CO2 | ||
| C. | NaCl-Na2SO4-Na2S-NaOH-CH3COOH | D. | Na2S-Na2SO4-NaCl-NaOH-HCl |
14.下列说法中正确的是( )
| A. | 失去电子的是还原剂,表现氧化性 | |
| B. | 氧化还原反应的本质是元素化合价的升降 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 氧化还原反应中,某元素由化合物变为单质,此元素可能被还原,也可能被氧化 |
4.将下列每组内的四种物质同时加入到水中,充分搅拌后,既有氧化还原反应发生,又有沉淀产生的一组是( )
| A. | Na2O2、NH4Cl、NaCl、Na2SO4 | B. | FeO、AlCl3、Na2SiO3、硝酸 | ||
| C. | KHCO3、Ca(OH)2、MgCl2、硫酸 | D. | NaCO3、BaCl2、K2S、盐酸 |
3.反应Fe(固)+CO2(气)?FeO(固)+CO(气)的平衡常数为K1;
反应Fe(固)+H2O(气)?FeO(固)+H2(气)的平衡常数为K2.
在不同温度时K1、K2的值如下表:
(1)推导反应CO2(气)+H2(气)?CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:$\frac{{K}_{1}}{{K}_{2}}$.
(2)计算K值:温度为973开时K=0.618;1173开时:K=1.29.通过K值的计算(1)反应是吸热 反应(填“吸热”或“放热”).
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2,在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件.各物质的浓度变化如下表:
①前2min,用CO表示的该化学反应的速率是:0.0013mol/(L.min).
②在3~4min之间,反应处于平衡状态(填“平衡”或“非平衡”).
③第6min时,平衡向正反应方向移动,可能的原因是升高温度或移走水蒸气.
反应Fe(固)+H2O(气)?FeO(固)+H2(气)的平衡常数为K2.
在不同温度时K1、K2的值如下表:
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(2)计算K值:温度为973开时K=0.618;1173开时:K=1.29.通过K值的计算(1)反应是吸热 反应(填“吸热”或“放热”).
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2,在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件.各物质的浓度变化如下表:
| 时间/min | CO2 | H2 | CO | H2O |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
②在3~4min之间,反应处于平衡状态(填“平衡”或“非平衡”).
③第6min时,平衡向正反应方向移动,可能的原因是升高温度或移走水蒸气.
20.下列说法不正确的是( )
| A. | 很多食物含有维生素,但蔬菜、水果比其他食物能提供更多的维生素 | |
| B. | 选择食物时,要考虑含营养素的种类、含量及是否易被人体吸收和利用 | |
| C. | 人体每天需要营养素的量是相对稳定的 | |
| D. | 三大热能食物中,糖类提供的热能最多,热值也最大 |