题目内容
13. 一定量的NaOH和Na2CO3的混合物,溶于水配成100mL溶液,然后用2mol•L-1的盐酸滴定(指示剂先为酚酞试剂,后用甲基橙试液),得到如图所示图象,回答下列问题:
一定量的NaOH和Na2CO3的混合物,溶于水配成100mL溶液,然后用2mol•L-1的盐酸滴定(指示剂先为酚酞试剂,后用甲基橙试液),得到如图所示图象,回答下列问题:(1)写出依次发生的三个离子反应方程式:
①H++OH-=H2O;
②CO32-+H+=HCO3-;
③HCO3-+H+=H2O+CO2↑.
(2)原混合物中m(NaOH)=0.4g;m(Na2CO3)=10.6g;
(3)标准状况下a=2.24L.
分析 (1)NaOH和Na2CO3的混合物加入盐酸,先和氢氧化钠之间反应,然后是和碳酸钠反应生成碳酸氢钠和水,接着是碳酸氢钠溶液和盐酸反应生成氯化钠、水以及二氧化碳之间的反应;
(2)结合盐酸的用量计算碳酸钠的物质的量,根据碳元素守恒结合盐酸的量计算氢氧化钠的量;
(3)根据碳酸氢钠和盐酸反应产生气体的反应方程式来计算.
解答 解:(1)NaOH和Na2CO3的混合物加入盐酸,先和氢氧化钠之间反应,H++OH-=H2O,然后是和碳酸钠反应生成碳酸氢钠和水,CO32-+H+=HCO3-,接着是碳酸氢钠溶液和盐酸反应生成氯化钠、水以及二氧化碳之间的反应HCO3-+H+=H2O+CO2↑,故答案为:H++OH-=H2O;CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑;
(2)根据反应:HCO3-+H+=H2O+CO2↑,开始产生二氧化碳到最大量,消耗盐酸是(105-55)×0.001L×2mol/L=0.1mol,产生二氧化碳是0.1mol,根据碳元素守恒所以碳酸钠的物质的量是0.1mol,CO32-+H+=HCO3-,该过程消耗盐酸是0.1mol,体积是50mL,所以和氢氧化钠反应的盐酸是5mL,物质的量是0.01mol,所以氢氧化钠质量是0.01mol×40g/mol=0.4g,碳酸钠的质量是0.1mol×106g/mol=10.6g,故答案为:0.4g;10.6g;
(3)根据反应:HCO3-+H+=H2O+CO2↑,开始产生二氧化碳到最大量,消耗盐酸是(105-55)×0.001L×2mol/L=0.1mol,产生二氧化碳是0.1mol,标况下体积是2.24L,故答案为:2.24L.
点评 碳酸钠和氢氧化钠的混合物与盐酸反应,注意反应的先后顺序以及方程式的计算是关键,难度中等.

| A. | 四氯化碳 | B. | 乙醇 | C. | 已烷 | D. | 溴苯 |
| A. | CO2 | B. | H2O | C. | NH3 | D. | H2 |
| A. | 化学性质不同的氢原子 | B. | 四种不同的元素 | ||
| C. | 氢元素的四种不同粒子 | D. | 四种不同的氢元素 |
| A. | 11.2 L氧气与臭氧的混合气体中含NA个氧原子 | |
| B. | 60 g SiO2晶体中含有2NA个Si-O键 | |
| C. | 标准状况下,22.4 LSO2的中心原子所含有的孤电子对数为2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
| A. | 间二甲苯只有一种 | B. | 对二甲苯只有一种 | ||
| C. | 邻二甲苯只有一种 | D. | 苯能与液溴反应 |
 用碱性锌锰电池做电源进行电解实验,装置如图.图中A装置中盛1L2mol/LAgNO3溶液,B装置盛1L2mol/LNa2SO4溶液,C和D为润湿的淀粉KI试纸的两端.通电后电解一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
用碱性锌锰电池做电源进行电解实验,装置如图.图中A装置中盛1L2mol/LAgNO3溶液,B装置盛1L2mol/LNa2SO4溶液,C和D为润湿的淀粉KI试纸的两端.通电后电解一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答: 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.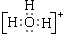 .
.