题目内容
(1)写出一个能证明还原性Fe比Cu强的离子方程式:
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液 )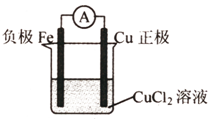
 ;
;
(3)若该电池中两电极的总质量为60g,工作一段时间后,取出两电极洗净干燥后称量,总质量为62g,则反应过程中转移电子的数目为
Fe+Cu2+=Fe2++Cu
Fe+Cu2+=Fe2++Cu
;(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液 )


(3)若该电池中两电极的总质量为60g,工作一段时间后,取出两电极洗净干燥后称量,总质量为62g,则反应过程中转移电子的数目为
3.01×1023或0.5NA
3.01×1023或0.5NA
.分析:(1)铁比铜的还原性强,可与Cu2+发生置换反应,以此证明;
(2)在Fe+Cu2+=Fe2++Cu反应中,Fe被氧化,应为原电池的负极,电解反应为:Fe-2e-=Fe2+,Cu2+得电子被还原生成单质
Cu,电极反应为Cu2++2e-=Cu,应为原电池正极反应,正极材料为活泼性比Fe的金属或非金属材料,电解质溶液为含Cu2+离子的溶液,如CuCl2,
(3)根据电极反应式计算.
(2)在Fe+Cu2+=Fe2++Cu反应中,Fe被氧化,应为原电池的负极,电解反应为:Fe-2e-=Fe2+,Cu2+得电子被还原生成单质
Cu,电极反应为Cu2++2e-=Cu,应为原电池正极反应,正极材料为活泼性比Fe的金属或非金属材料,电解质溶液为含Cu2+离子的溶液,如CuCl2,
(3)根据电极反应式计算.
解答:(1)铁比铜的还原性强,可与Cu2+发生置换反应,反应的离子方程式为Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu;
(2)在Fe+Cu2+=Fe2++Cu反应中,Fe被氧化,应为原电池的负极,Cu2+得电子被还原生成单质Cu,正极材料为活泼性比Fe的金属如Cu或非金属材料,电解质溶液为含Cu2+离子的溶液,如CuCl2,故答案为:

(3)设用xmolFe反应,根据电池总反应式计算,
Fe+Cu2+=Fe2++Cu△m
1mol 8g
xmol 62g-60g=2g
x=0.25,
根据电极反应式可知Fe-2e-=Fe2+,转移的电子的物质的量为0.5mol,
反应过程中转移电子的数目为3.01×1023或0.5NA,故答案为:3.01×1023或0.5NA.
(2)在Fe+Cu2+=Fe2++Cu反应中,Fe被氧化,应为原电池的负极,Cu2+得电子被还原生成单质Cu,正极材料为活泼性比Fe的金属如Cu或非金属材料,电解质溶液为含Cu2+离子的溶液,如CuCl2,故答案为:

(3)设用xmolFe反应,根据电池总反应式计算,
Fe+Cu2+=Fe2++Cu△m
1mol 8g
xmol 62g-60g=2g
x=0.25,
根据电极反应式可知Fe-2e-=Fe2+,转移的电子的物质的量为0.5mol,
反应过程中转移电子的数目为3.01×1023或0.5NA,故答案为:3.01×1023或0.5NA.
点评:本题考查原电池的设计和有关计算,题目难度不大,注意原电池的组成和工作原理,根据电极反应式计算.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目