题目内容
【题目】常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )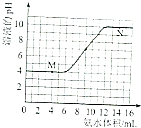
A.该土壤是酸性土壤
B.当溶液中c(H+)=c(OH﹣)时,消耗氨水的体积为9mL
C.M、N点由水电离出的氢离子浓度一定相等
D.将20mL此氨水与10mL同浓度的盐酸混合,充分反应后存在:C(NH4+)>c(Cl﹣)>c(NH3H2O)>c(OH﹣)>c(H+)
【答案】C
【解析】解:A.由图可知,该土壤浸出溶液pH=4,该土壤是酸性土壤,故A正确;
B.当溶液中c(H+)=c(OH﹣)时,即pH=7,根据图可知消耗氨水的体积为9mL,故B正确;
C.N点氨水过量,N点溶液中氢离子源于水的电离,M点溶液酸性可能是离子水解导致,也可能是酸电离导致,若为酸电离导致,M、N点由水电离出的氢离子浓度相等,若由离子水解导致,该情况下溶液中氢离子源于水的电离,M点由水电离出的氢离子浓度大于N点,故C错误;
D.将20mL此氨水与10mL同浓度的盐酸混合,得到等浓度的NH4Cl、NH3H2O混合溶液,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,但弱电解质电离程度不大.,溶液中c(NH4+)>c(Cl﹣)>c(NH3H2O)>c(OH﹣)>c(H+),故D正确.
故选:C.
A.由图可知,该土壤浸出溶液pH=4; B.当溶液中c(H+)=c(OH﹣)时,即pH=7,根据图可知消耗氨水的体积; C.M点溶液酸性可能是离子水解导致,也可能是酸电离导致,N点氨水过量,N点溶液中氢离子源于水的电离; D.将20mL此氨水与10mL同浓度的盐酸混合,得到等浓度的NH4Cl、NH3H2O混合溶液,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,但弱电解质电离程度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案