题目内容
【题目】某反应2NH3![]() N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
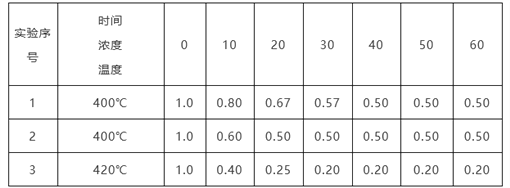
根据上述数据,回答下列问题:
(1)在实验1、2中,有一个实验使用了催化剂,它是______(填字母)。
A.实验1 B.实验2
(2)在实验3中,平衡时NH3的转化率为__________________。
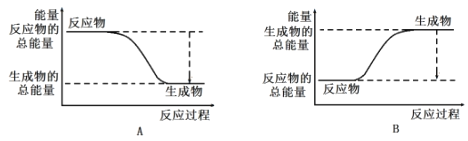
(3)工业合成氨的反应如下:N2+3H2![]() 2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
【答案】 B 80% 92 A
【解析】分析:(1)由表中数据可知,实验1、2比较,实验2达到平衡需要的时间少;
(2)实验3中氨气的起始浓度为1mol/L,平衡时氨气为0.2mol/L,可知参加反应的氨气为0.8mol/L;
(3)焓变等于断裂化学键吸收的能量减去成键释放的能量,放热反应的焓变为负,以此来解答。
详解:(1)由表中数据可知,实验1、2比较平衡状态相同,但实验2达到平衡需要的时间少,则实验2使用了催化剂,答案选B;
(2)实验3中氨气的起始浓度为1mol/L,平衡时氨气为0.2mol/L,可知参加反应的氨气为0.8mol/L,因此达平衡时NH3的转化率为![]() ×100%=80%;
×100%=80%;
(3)断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中△H=946kJ/L+3×436kJ/mol-2×1173kJ/mol=-92kJ/mol,即由N2和H2生成2molNH3过程中的放出能量为92kJ,反应物总能量大于生成物总能量,图A符合,答案选A。

 阅读快车系列答案
阅读快车系列答案