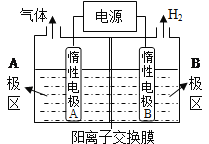
题目内容
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式:H2B=H++HB-,HB-![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1) NaHB溶液显 (填“酸性”“中性”或“碱性”)。理由是 。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)0.1 mol·L-1 Na2B溶液中各种离子浓度由大到小的顺序是 。
【答案】(1)酸性 HB-只发生电离,不会水解。
(2)B、C、D
(3)c(Na+)>c(B2-)>c(OH-)>c(HB-)>c(H+)
【解析】
试题分析:(1)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,NaHB溶液显酸性;
(2)A.H2B第一步完全电离,所以溶液中不存在H2B,故B错误;B.H2B第一步完全电离,所以溶液中不存在H2B,溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HB-),故B正确;C.根据电荷守恒得c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- ),故C正确;D.根据物料守恒得c(Na+)=2c(B2- )+2c(HB- ),故D正确;答案为BCD;
(3)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性,其水解方程式为:B2-+H2OHB-+OH-,溶液里各离子微粒的浓度大小关系为c(Na+)> c(B2-) > c(OH-) > c(HB-) > c(H+)。