题目内容
2.在20℃时,某气态烃与氧气混合,装入密闭容器中,点燃爆炸后,又恢复到20℃,此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎成真空,此烃的分子式可能是( )| A. | CH4 | B. | C2H4 | C. | C4H8 | D. | C7H16 |
分析 气态烃与氧气混合,装入密闭容器中,经充分反应后,生成二氧化碳和水,容器内气体分子是反应前的一半.再经足量的氢氧化钠溶液吸收后,容器内几乎成真空说明生成的二氧化碳的分子总数是碳氢化合物与氧气分子总数的一半.
解答 解:设此气态烃的化学式为CxHy,则有:
4CxHy+(4x+y)O2$\frac{\underline{\;点燃\;}}{\;}$4xCO2+2yH2O
根据题意可知4+4x+y=2×4x,
由此可得:4x=4+y
若x=1,则y=0,不存在此物质,
若x=2,则y=4,物质为C2H4,
若x=3,则y=8,物质为C3H8,
若x>3,不符合烃的组成.
故选:B.
点评 考查学生利用化学方程式中化学计量数来分析物质间反应时气体体积的变化,注意在不同温度下水的状态,明确分析的是气体体积的关系是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列各组离子中,可以大量共存的是( )
| A. | Ag+、NO3-、Cl- | B. | OH-、Cl-、NH4+ | C. | Ba2+、Cl-、SO42- | D. | Mg2+、Cl-、NO3- |
15.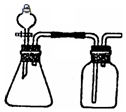 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
①亚硫酸钠和浓硫酸
②铝和烧碱溶液
③铜和稀硝酸
④铜和浓硫酸
⑤双氧水(H2O2)和二氧化锰
⑥铜和浓硝酸.
 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )①亚硫酸钠和浓硫酸
②铝和烧碱溶液
③铜和稀硝酸
④铜和浓硫酸
⑤双氧水(H2O2)和二氧化锰
⑥铜和浓硝酸.
| A. | ①⑤⑥ | B. | ①③⑥ | C. | ①②⑤ | D. | ③⑤⑥ |
12.在一定温度下,将2molSO2和1molO2充入一固定容积的密闭容器中,在催化剂作用下发生如下放热反应:2SO2(g)+O2(g)?2SO3(g),对该反应的下列说法中正确的是( )
| A. | 若向该体系中通入过量的二氧化硫,则氧气的转化率可达到100% | |
| B. | 该反应过程中SO2和O2的总能量一定低于SO3的总能量 | |
| C. | 当达到化学平衡时,该容器中SO2和SO3共2mol | |
| D. | 当达到反应限度时,单位时间内生成nmolO2,同时消耗2n molSO3 |
7.下列气体不能用排水法收集的是( )
| A. | NO | B. | NO2 | C. | O2 | D. | CO |
14.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3 <H2SO4,判断硫与碳的非金属性强弱 | |
| D. | F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱 |
11.19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
| A. | 提出了原子学说 | B. | 提出了元素周期律 | ||
| C. | 提出了相对论 | D. | 制定了第一张元素周期表 |
12.下列过程不属于化学变化的是( )
| A. | 从铜矿中冶炼铜 | B. | 从铝矿中炼铝 | ||
| C. | 从海水中冶炼钠 | D. | 从铁矿中开采铁矿石 |
 如图电解装置中,电极A是由金属M制成的,B、C和D都是铂电极,甲中的电解质溶液为MSO4,乙中的电解质为H2SO4.E、F是外接直流电源的两极,电路接通后,电极B上有金属M析出.(已知金属M无变价)
如图电解装置中,电极A是由金属M制成的,B、C和D都是铂电极,甲中的电解质溶液为MSO4,乙中的电解质为H2SO4.E、F是外接直流电源的两极,电路接通后,电极B上有金属M析出.(已知金属M无变价)