题目内容
COCl2(g) CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.②③⑥ C.①④⑥ D.③⑤⑥
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________ 。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。

(1)此装置哪些地方需要改进:________________
(2)写出该反应的中和热的热化学方程式(中和热为57.3 kJ·mol-1):__________________
(3)取50 mL NaOH溶液和30 mL硫酸溶液按正确装置进行实验,实验数据如下表。
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
①近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=_______________(取小数点后一位)。
②上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)如果用50 mL 0.55 mol·L-1的氨水代替NaOH溶液进行上述实验,其放出的热量偏小,原因是________________________
下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物[来源 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | 碳酸钠 |


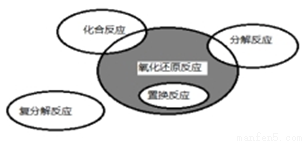
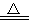 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑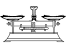
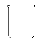



 C(g)+D(s) 正反应速率加快的是
C(g)+D(s) 正反应速率加快的是