题目内容
【题目】(1)18.6g Na2X含有0.6mol Na+,则X的相对原子质量为_______,该物质的化学式为________。
(2)与0.2mol H2含有相同电子数目的氦气分子的物质的量为__________。
(3)标准状况下,1.6 g某气态氧化物RO2体积为0.56 L,该气体的物质的量为________mol,RO2的相对分子质量为__________。
(4)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75 g/L,该混合气体的平均摩尔质量为__________,该气体对氢气的相对密度为__________,NH3的体积分数为__________。
(5)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(6)相同条件下,H2和O2的体积比为m∶n和质量比为m∶n的混合气体,其平均相对分子质量分别是_______________和______________。
【答案】16Na2O0.2 mol0.025 mol6416.8 g/mol8.480%![]() L
L![]()
![]()
【解析】
(1)Na2X中含有0.4molNa+,Na2X的物质的量为0.2mol,则Na2X的摩尔质量=![]() =62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na2O,故答案为: 16;Na2O;
=62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na2O,故答案为: 16;Na2O;
(2)与0.2mol H2含有电子0.2mol×2=0.4mol,含有相同电子数目的氦气的物质的量为![]() =0.2mol,故答案为:0.2mol;
=0.2mol,故答案为:0.2mol;
(3)标准状况下,Vm=222.4L/mol,1.6g某气态氧化物RO2的体积为0.56L,其物质的量为![]() =0.025mol,其摩尔质量为
=0.025mol,其摩尔质量为![]() =64g/mol,故RO2的相对分子质量为64,故答案为:0.025mol;64;
=64g/mol,故RO2的相对分子质量为64,故答案为:0.025mol;64;
(4)混合气体在标准状况下的密度为0.75g/L,则混合气体的平均摩尔质量为0.75g/L×22.4L/mol=16.8g/mol,根据十字交叉法计算混合气体中NH3和CH4的体积比: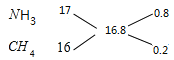 ,所以混合气体中NH3和CH4的体积比为0.8∶0.2=4∶1;即氨气的体积分数=
,所以混合气体中NH3和CH4的体积比为0.8∶0.2=4∶1;即氨气的体积分数=![]() ×100%=80%;由于混合气体的平均摩尔质量为16.8g/mol,而氢气的摩尔质量为2g/mol,故混合气体对氢气的相对密度为
×100%=80%;由于混合气体的平均摩尔质量为16.8g/mol,而氢气的摩尔质量为2g/mol,故混合气体对氢气的相对密度为![]() =8.4,故答案为: 16.8g/mol;8.4; 80%;
=8.4,故答案为: 16.8g/mol;8.4; 80%;
(5)a克某气体中含有的分子数为b,则c克气体含有的分子数为![]() ,c克该气体的物质的量为
,c克该气体的物质的量为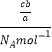 =
=![]() mol,在标准状况下,cg气体的体积=
mol,在标准状况下,cg气体的体积=![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L,故答案为:
L,故答案为:![]() L;
L;
(6)平均摩尔质量为:M=![]() ,相同条件下,氢气和氧气的体积比为m∶n,物质的量之比为m∶n,二者平均摩尔质量为
,相同条件下,氢气和氧气的体积比为m∶n,物质的量之比为m∶n,二者平均摩尔质量为![]() g/mol,相对分子量为
g/mol,相对分子量为![]() ;质量比m∶n的H2和O2的混合气体,物质的量之比为
;质量比m∶n的H2和O2的混合气体,物质的量之比为![]() ∶
∶![]() =16m∶n,平均摩尔质量为
=16m∶n,平均摩尔质量为![]() g/mol=
g/mol=![]() g/mol,平均分子量为
g/mol,平均分子量为![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。

【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是_____(填字母)。
a.电子从基态跃迁到较高的激发态 b.电子从较高的激发态跃迁到基态
c.焰色反应的光谱属于吸收光谱 d.焰色反应的光谱属于发射光谱
(2)基态Cu原子中,核外电子占据的最高能层符号是_____,其核外电子排布式中未成对电子数为______个,Cu与Ag均属于IB族,熔点:Cu____Ag(填“>”或“<”)。
(3)[Cu(NH3)4]SO4中阴离子的立体构型是_________;中心原子的轨道杂化类型为__________,[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为________________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛中σ键和π键的比值为___________。
(5)碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
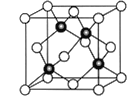
(6)Cu与Cl形成某种化合物的晶胞如图所示,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为__________(用含ρ、a的代数式表示)。