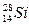题目内容
在下列的叙述中,正确的是
| A.将碳酸钡放在水中不导电,碳酸钡是非电解质 |
| B.二氧化硫水溶液能导电,二氧化硫是电解质 |
| C.食盐晶体熔化或溶于水时,其化学键都被破坏 |
| D.固体磷酸是电解质,所以它在熔化或溶于水时都能导电 |
C
选项A不正确。因为在溶于水不导电的化合物不一定不是电解质。如BaCO3、BaSO4、CaCO3、AgCl等难溶盐,因溶解度太小而测不出导电性,但它们的电离度都很大,其所溶的部分几乎是全部电离,所以都属于强电解质。
选项B也是错误的。因为电解质导电必须是电解质溶于水(或熔融)时本身电离出离子导电。而SO2溶于水后成亚硫酸。此酸电离出H+和HSO3-导电。而不是SO2本身电离出来的,所以,SO2不是电解质。
选项C是正确的。因为NaCl是离子晶体,在熔化时,破坏了化学键,电离出自由离子。在溶于水时,由于极性水分子的作用,破坏了化学键,形成了自由的水合离子。所以C是正确的。
选项D不对。因为磷酸是共价化合物。溶于水时,破坏了化学键,形成了自由的水合离子。但在熔化时,破坏了分子晶体内的范德华力,有自由分子而无自由离子。所以,磷酸在溶液中能导电,但在熔融态时不能导电。

练习册系列答案
相关题目
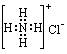

 H
H