题目内容
(1)已知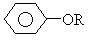 +HI(浓)
+HI(浓)
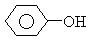 +RI,现有一芳香族化合物(A),分子式为C8H10O2,(A)溶于NaOH溶液而不溶于NaHCO3溶液,与浓HI反应后得(B)和(C);(B)的分子式为C6H6O2;(C)与NaOH
+RI,现有一芳香族化合物(A),分子式为C8H10O2,(A)溶于NaOH溶液而不溶于NaHCO3溶液,与浓HI反应后得(B)和(C);(B)的分子式为C6H6O2;(C)与NaOH H2O溶液作用得(D),同时用AgNO3检验有黄色沉淀;(C)与NaOH
H2O溶液作用得(D),同时用AgNO3检验有黄色沉淀;(C)与NaOH C2H5OH作用得(E),(E)蒸气导入溴水中,溴水立即褪色;(B)与FeCl3溶液作用显蓝紫色,在单溴化条件下只得一种一溴取代物,试写出(A)、(B)、(C)、(D)、(E)的结构简式.
C2H5OH作用得(E),(E)蒸气导入溴水中,溴水立即褪色;(B)与FeCl3溶液作用显蓝紫色,在单溴化条件下只得一种一溴取代物,试写出(A)、(B)、(C)、(D)、(E)的结构简式.
(A)________ (B)________ (C)________ (D)________ (E)________
(2)已知丙二酸(HOOC CH2
CH2 COOH)用P2O5脱水得到的主要产物的化学式为C3O2,它与水加成仍得到丙二酸.C3O2是一种非常活泼的化合物,除与H2O加成外,还能跟NH3、HCl、ROH(R为链烃基)等加成,如:
COOH)用P2O5脱水得到的主要产物的化学式为C3O2,它与水加成仍得到丙二酸.C3O2是一种非常活泼的化合物,除与H2O加成外,还能跟NH3、HCl、ROH(R为链烃基)等加成,如:
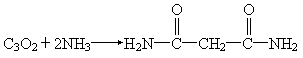
试回答:
①C3O2的结构式为________;
②C3O2与HCl、C2H5OH分别发生加成反应的化学方程式:
________________________、________________________
答案:
解析:
解析:
|
(1)A. (2)①O=C=C=C=O ②
|

练习册系列答案
相关题目
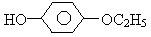 ,B.
,B.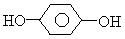 ,C.CH3CH2I,D.C2H5OH,E.CH2=CH2
,C.CH3CH2I,D.C2H5OH,E.CH2=CH2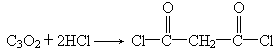
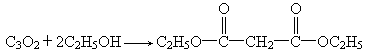
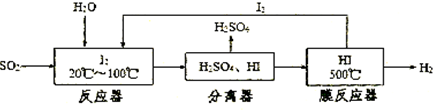
 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应: