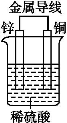
题目内容
已知:①CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH1=-Q1
CO2(g)+2H2O(l) ΔH1=-Q1
②H2(g)+O2(g) H2O(g) ΔH2=-Q2
H2O(g) ΔH2=-Q2
③H2(g)+O2(g) H2O(l) ΔH3=-Q3,常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况),经完全燃烧恢复到常温,放出的热量是( )
H2O(l) ΔH3=-Q3,常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况),经完全燃烧恢复到常温,放出的热量是( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3D.0.4Q1+0.1Q3
D
【解析】标准状况下,11.2 L混合气体中,n(CH4)=×0.5 mol=0.4 mol,则n(H2)=0.1 mol,由于完全燃烧恢复到室温时,水为液体,因此H2燃烧放出的热量应按③进行计算,结果为0.4Q1+0.1Q3。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目