题目内容
900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应: ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前20 min的平均速率为v(H2)=0.008 mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,达到平衡前v正>v逆
C
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) △H=-57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是
N2O4(g) △H=-57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如下图所示。下列说法正确的是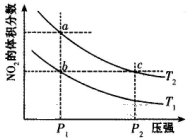
| A.a、c两点的反应速率:a>c |
| B.a、b两点的转化率:a<b |
| C.a、c两点气体的颜色:a深,c浅 |
| D.由a点到b点,可以用加热的方法 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是
| A.反应达到平衡时, X的转化率为50% |
B.反应可表示为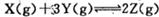 |
| C.增大压强可使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
反应CO+H2O(g) CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
| A.将压强减小至原来的一半 | B.将反应温度升高 |
| C.添加催化剂 | D.增大水蒸气的浓度 |
一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应,在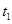 时达平衡:
时达平衡: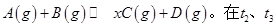 时刻分别改变反应的一个条件,测得溶器中C(g)的浓度随时间变化如图所示。有关说法正确的是
时刻分别改变反应的一个条件,测得溶器中C(g)的浓度随时间变化如图所示。有关说法正确的是
A.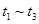 间该反应的平衡常数相同,均为0.25 间该反应的平衡常数相同,均为0.25 |
B.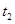 时刻改变的条件是使用催化剂 时刻改变的条件是使用催化剂 |
C. 时刻改变的条件是移去少量D 时刻改变的条件是移去少量D |
| D.反应方程式中x=2 |
在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)
 I3-(aq)的ΔH>0
I3-(aq)的ΔH>0B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=
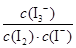
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
某温度下,反应2A(g) B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后
B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后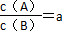 ,若改变某一条件,足够时间后反应再次达到平衡状态,此时
,若改变某一条件,足够时间后反应再次达到平衡状态,此时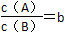 ,下列叙述正确的是 ( )。
,下列叙述正确的是 ( )。
| A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b |
| B.若a=b,则B容器中一定使用了催化剂 |
| C.若其他条件不变,升高温度,则有a<b |
| D.若保持温度、压强不变,充入惰性气体,则有a>b |
2SO2(g)+O2(g) 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
| A.催化剂V2O5可改变该反应的正、逆反应速率 |
| B.增大反应体系的压强、反应速率一定增大 |
| C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1,t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v= |
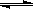 B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是