题目内容
【题目】工业上用氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下:
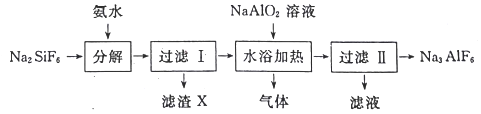
(1)分解过程发生的反应为:Na2SiF6+4NH3H2O═2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为______________________。
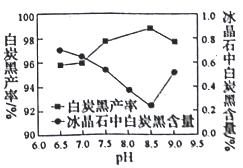
(2)分解时白炭黑产率和冰晶石纯度与pH的关系如图所示,分解时需要控制溶液的pH=________;能提高其分解速率的措施有___________ (填标号)。
A.快速搅拌B.加热混合液至100℃C.降低氨水浓度
(3)流程中可循环利用的物质为_________(写化学式);冰晶石在电解冶炼铝中的作用是降低氧化铝的熔融温度、________________________和提髙产率。
(4)水浴加热过程中生成冰晶石的化学方程式为_____________________________。
【答案】 SiO2 8.5 A NH3(或NH3·H2O) 减少能源消耗(或降低生产成本) 2NaF+4NH4F+NaAlO2 ![]() NaAlF6↓+4 NH3↑+2 H2O
NaAlF6↓+4 NH3↑+2 H2O
【解析】(1)分解过程发生的反应为:Na2SiF6+4NH3H2O=2NaF+4NH4F+X↓+2H2O,化学反应前后原子守恒,则X为SiO2;(2)从图可知,pH为8.5时,冰晶石中白炭黑的含量较低,冰晶石纯度较高;能提高其分解速率的措施有A.快速搅拌可以加快反应速率,A正确;B.加热混合液至100℃,氨水受热分解,反应物浓度小,化学反应速率减慢,B错误;C.降低氨水浓度,化学反应速率减慢,C错误;答案选A;(3)第二次过滤所得滤液为氨气水溶液,可循环使用;冰晶石降低氧化铝的熔融温度,减少能源消耗(或降低生产成本);(4)根据以上分析可知水浴加热过程中生成冰晶石的化学方程式为2NaF+4NH4F+NaAlO2 ![]() NaAlF6↓+4 NH3↑+2H2O。
NaAlF6↓+4 NH3↑+2H2O。

 精英口算卡系列答案
精英口算卡系列答案【题目】根据所学知识填空。
(1)与标准状况下4.48L CO2中所含氧原子数目相同的水的质量是g;
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42﹣的物质的量浓度为mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为 , 气体所处的条件(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
药名 | 胃舒平 | 达喜 |
有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO34H2O |
相对分子质量 | 78 | 530 |
每片含有效成份的药量 | 0.245g | 0.5g |
估算10片胃舒平和5片达喜,含铝的物质的量较多的是 .