题目内容
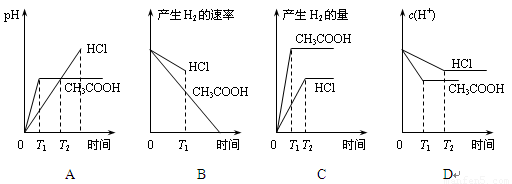
在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是

【答案】
C
【解析】
试题分析:0.65g锌的物质的量=0.65g÷65g/mol=0.01mol,需要盐酸和醋酸的物质的量都是0.02mol。盐酸是强酸,醋酸是弱酸,在pH都是2的情况下盐酸的浓度是0.01mol/L,而醋酸的浓度大于0.01mol/L。溶液的体积都是1L,因此盐酸的物质的量是0.01mol,醋酸的物质的量大于0.01mol。所以与0.65g锌反应时盐酸不足,醋酸过量,即醋酸产生的氢气多。在反应过程中醋酸还可以继续电离出氢离子,所以醋酸的反应速率快,因此C正确。A、起始时溶液的pH=2,而不是0,A不正确;B、产生氢气的速率醋酸快,B不正确;D、在反应过程中醋酸溶液中氢离子浓度大于盐酸溶液中氢离子浓度,D不正确,答案选C。
考点:考查盐酸、醋酸与锌的反应的有关判断、计算以及图像分析

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目