题目内容
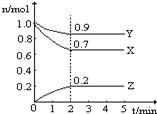
在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。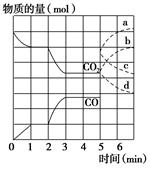
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=________。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH________0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写编号)。
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:_____________。
(1)0.1 mol·L-1·min-1
(2)>
(3)c b (4)Fe(或FeO)的质量(或物质的量)保持不变;或固体总质量保持不变
解析

一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+
2NH3+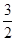 O2
O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol·h-1。
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是 。
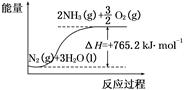
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:①该条件下的平衡常数为 ;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量 (填“>”“<”或“=”)92.4 kJ。
已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |

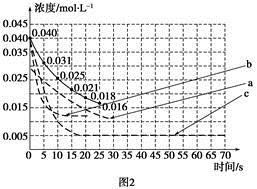
①若反应延续至70 s。请在图1中用实线画出25 s至70 s的反应进程曲线。
②某化学兴趣小组采用实验对比法分析改变实验条件对该反应进程的影响,每次只改变一个条件,并采集反应进程中CO2的浓度变化,在原有反应进程图像上绘制对应的曲线。实验数据如下表:
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
但是该小组负责绘制图线的学生未将曲线(虚线)绘制完整(见图2),也忘记了注明每条曲线所对应改变的条件,请把每个实验编号与图2中对应曲线的字母进行连线。
实验编号 图2中字母
A a
B b
C c
有A、B、C、D四个反应:
| 反应 | A | B | C | D |
| ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
则在任何温度下都能自发进行的反应是 ;任何温度下都不能自发进行的反应是 ;另两个反应中,在温度高于 ℃时可自发进行的反应是 ;在温度低于 ℃时可自发进行的反应是 。
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | ½ | 0.1 |
| ⅱ | ________ | ________ | 5 |
| ⅲ | 350 | ________ | 5 |
t ℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)  2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)________。
| A.容器内压强不再发生变化 |
| B.SO2的体积分数不再发生变化 |
| C.容器内气体原子总数不再发生变化 |
| D.相同时间内消耗2n mol SO2的同时消耗n mol O2 |
(3)t2℃时,若将物质的量之比n(SO2)∶n(O2)=1∶1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0 Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2 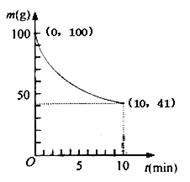
 Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应