题目内容
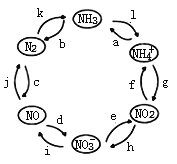
【题目】氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题:
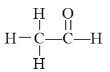
(1)氮分子的电子式为______________________。
(2)图中属于“氮的固定”的是___________(填字母)。
(3)已知NH4Cl溶液呈酸性,用离子方程式解释原因___________________________________________ 。
(4)用离子方程式举一例表示循环中发生非氧化还原反应的过程__________________。
(5)若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂物质的量之比为____________。
(6)若反应i是在酸性条件下由NO3—与Fe2+的作用实现,则该反应的离子方程式为_______________。
【答案】![]() k和c NH4++H2ONH3·H2O+H+ NH4++OH—
k和c NH4++H2ONH3·H2O+H+ NH4++OH—![]() NH3↑+H2O或 NH3+H+ =NH4+ 1:2 3Fe2++ NO3 + 4H+=3Fe3++NO↑+2H2O
NH3↑+H2O或 NH3+H+ =NH4+ 1:2 3Fe2++ NO3 + 4H+=3Fe3++NO↑+2H2O
【解析】
掌握氮的固定为游离态变为化合态的过程。有元素化合价变化的反应为氧化还原反应。硝酸根离子在酸性条件下有强氧化性,能氧化亚铁离子生成铁离子。
(1)氮气分子中氮原子之间形成氮氮三键,电子式为: ![]() ;
;
(2)氮的固定是指由游离态变为化合态,所以属于氮的固定的为k和c。
(3)氯化铵溶液中铵根离子水解显酸性,离子方程式为:NH4++H2ONH3·H2O+H+;
(4)没有化合价变化的反应为非氧化还原反应,其中有 NH4++OH—![]() NH3↑+H2O或 NH3+H+ =NH4+ 。
NH3↑+H2O或 NH3+H+ =NH4+ 。
(5)二氧化氮和水反应生成硝酸和一氧化氮,方程式为:3NO2+H2O=2HNO3+NO,其中二氧化氮做氧化剂和还原剂,其物质的量之比为1:2。
(6)在酸性条件下硝酸根离子能氧化亚铁离子生成铁离子和一氧化氮,离子方程式为: 3Fe2++NO3+ 4H+=3Fe3++NO↑+2H2O。

【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
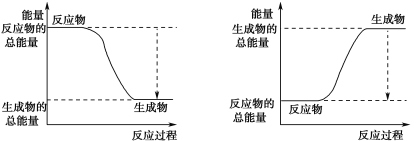
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止