题目内容
A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA3型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。据此回答下列问题:
(1)D元素在元素周期表中的位置是 。
(2)B与D所形成的化合物电子式为 。
(3)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,产生淡黄色沉淀,其反应的化学方程式为 。
(4)实验室里除去BA2气体,可用下列试剂中的 (填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.品红溶液
(5)由A、B、D三种元素所组成的某种盐水溶液显碱性,其原因是 (用离子方程式表示)。
(1)第四周期第ⅠA族
(2)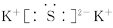
(3)K2S+Cl2=2KCl+S↓ (4)A、C
(5)SO32-+H2O HSO3-+OH-
HSO3-+OH-
【解析】A、B同主族,且能形成BA3型化合物,则A为O、B为S,根据B、C、D的离子电子层结构相同,可知都为18e-微粒,离子半径按照B、C、D的顺序减小,说明B、C、D三元素的原子序数关系为S<C<D,因为D的原子序数小于20,则C为Cl、D为K。
(1)K在元素周期表中的位置为第四周期第ⅠA族。
(2)S与K形成化合物的电子式为
(3)将氯水滴加到K2S溶液中发生反应K2S+Cl2=2KCl+S↓。
(4)除去SO2气体可以用酸性高锰酸钾溶液或NaOH溶液,A、C对;但是不能用浓硫酸吸收,SO2不溶于浓硫酸,B错;品红只是用来检验SO2的存在,一般不用来除去SO2,D错。
(5)K2SO3溶液显碱性的原因是SO32-的水解,SO32-+H2O HSO3-+OH-
HSO3-+OH-

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案

