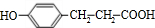题目内容
【化学一选修2:化学与技术】
锂电池具有质量轻、电压高、比能量大、安全性能好的诸多优点.某锂电池以嵌入锂原子的石墨为负极,含锂的过渡金属(M)氧化物为正极,锂盐有机溶液作电解质,电池反应式为:LiC6+Li1-xMO2
LiMO2+Li1-xC6
(1)电池放电时石墨电极上发生了 反应(选填“氧化”“还原”).
(2)充电时石墨电极上发生的电极反应式为 .回收利用锂是体现绿色化学的重要举措.某工厂对废旧锂离子电池正极材料(用LiMn2O4.碳粉等涂覆在铝箔上)进行资源收集,得到产品B.
设计工艺流程如下:
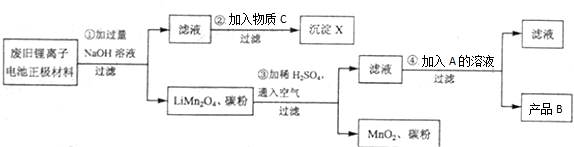
(3)A是制造普通玻璃的原料之一,其焰色反应为黄色,A的化学式为 ,产品B的化学式是 .
(4)鉴于该流程中的反应④,你建议该工厂与 联合生产,以降低成本.
(5)沉淀X脱水得到Y,工业上电解熔融Y生产某金属的化学反应方程式为 .
(6)第③步反应的化学反应方程式是 .
若各步的转化率均为100%,要产生74吨的产品B,③反应所需的硫酸需要 吨的硫黄来生产.
锂电池具有质量轻、电压高、比能量大、安全性能好的诸多优点.某锂电池以嵌入锂原子的石墨为负极,含锂的过渡金属(M)氧化物为正极,锂盐有机溶液作电解质,电池反应式为:LiC6+Li1-xMO2
| 放电 | 通电 |
(1)电池放电时石墨电极上发生了
(2)充电时石墨电极上发生的电极反应式为
设计工艺流程如下:

(3)A是制造普通玻璃的原料之一,其焰色反应为黄色,A的化学式为
(4)鉴于该流程中的反应④,你建议该工厂与
(5)沉淀X脱水得到Y,工业上电解熔融Y生产某金属的化学反应方程式为
(6)第③步反应的化学反应方程式是
若各步的转化率均为100%,要产生74吨的产品B,③反应所需的硫酸需要
分析:(1)负极失电子,发生氧化反应;
(2)充电时石墨电极上Li+得电子生成Li;
(3)根据焰色反应和物质的用途分析;根据对角线规则,Li2CO3性质与MgCO3相似,难溶于水,结合溶液中的离子分析;
(4)鉴于该流程中的反应④,要消耗Na2CO3;
(5)有流程图可知X为氢氧化铝,所以Y为氧化铝;
(6)第③步发生的反应为LiMn2O4、H2SO4和O2之间的反应,根据得失电子守恒和原子守恒平衡方程式;根据方程利用原子守恒分析计算.
(2)充电时石墨电极上Li+得电子生成Li;
(3)根据焰色反应和物质的用途分析;根据对角线规则,Li2CO3性质与MgCO3相似,难溶于水,结合溶液中的离子分析;
(4)鉴于该流程中的反应④,要消耗Na2CO3;
(5)有流程图可知X为氢氧化铝,所以Y为氧化铝;
(6)第③步发生的反应为LiMn2O4、H2SO4和O2之间的反应,根据得失电子守恒和原子守恒平衡方程式;根据方程利用原子守恒分析计算.
解答:解:(1)锂电池以嵌入锂原子的石墨为负极,负极失电子,所以石墨电极上发生了氧化反应,
故答案为:氧化;
(2)充电时石墨电极上Li+得电子生成Li,所以其电极反应式为:Li++e-═Li,
故答案为:Li++e-═Li;
(3)A是制造普通玻璃的原料之一,其焰色反应为黄色,所以A为Na2CO3;根据对角线规则,Li2CO3性质与MgCO3相似,难溶于水,溶液中含有大量的Li+离子,加Na2CO3会生成Li2CO3沉淀,所以产品B的化学式是Li2CO3,
故答案为:Na2CO3;Li2CO3;
(4)于该流程中的反应④,要消耗大量的Na2CO3,所以建议该工厂与纯碱工业联合生产,
故答案为:纯碱工业;
(5)有流程图可知X为氢氧化铝,所以Y为氧化铝,工业上电解熔融氧化铝生产Al的化学反应方程式为:2Al2O3(熔融)
4Al+3O2↑,
故答案为:2Al2O3(熔融)
4Al+3O2↑;
(6)第③步发生的反应为LiMn2O4、H2SO4和O2之间的反应,生成MnO2、Li2SO4和H2O,由失电子守恒和原子守恒平衡方程式为:4LiMn2O4+2H2SO4+O2═8MnO2+2Li2SO4+2H2O,
设反应所需的硫酸需要xt的硫黄来生产
由方程式可知:S~H2SO4 ~Li2SO4 ~Li2CO3
32 74
xt 74t
所以
=
,所以x=32t
故答案为:4LiMn2O4+2H2SO4+O2═8MnO2+2Li2SO4+2H2O;32.
故答案为:氧化;
(2)充电时石墨电极上Li+得电子生成Li,所以其电极反应式为:Li++e-═Li,
故答案为:Li++e-═Li;
(3)A是制造普通玻璃的原料之一,其焰色反应为黄色,所以A为Na2CO3;根据对角线规则,Li2CO3性质与MgCO3相似,难溶于水,溶液中含有大量的Li+离子,加Na2CO3会生成Li2CO3沉淀,所以产品B的化学式是Li2CO3,
故答案为:Na2CO3;Li2CO3;
(4)于该流程中的反应④,要消耗大量的Na2CO3,所以建议该工厂与纯碱工业联合生产,
故答案为:纯碱工业;
(5)有流程图可知X为氢氧化铝,所以Y为氧化铝,工业上电解熔融氧化铝生产Al的化学反应方程式为:2Al2O3(熔融)
| ||
故答案为:2Al2O3(熔融)
| ||
(6)第③步发生的反应为LiMn2O4、H2SO4和O2之间的反应,生成MnO2、Li2SO4和H2O,由失电子守恒和原子守恒平衡方程式为:4LiMn2O4+2H2SO4+O2═8MnO2+2Li2SO4+2H2O,
设反应所需的硫酸需要xt的硫黄来生产
由方程式可知:S~H2SO4 ~Li2SO4 ~Li2CO3
32 74
xt 74t
所以
| 32 |
| xt |
| 74 |
| 74t |
故答案为:4LiMn2O4+2H2SO4+O2═8MnO2+2Li2SO4+2H2O;32.
点评:本题为生产流程题,涉及金属的回收、氧化还原反应、物质的分离、金属的冶炼,有关方程式的计算等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
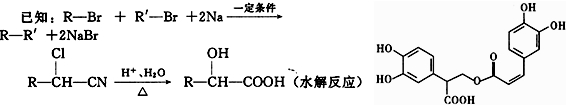
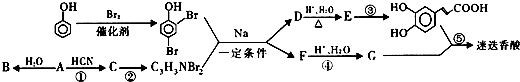

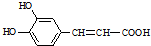 +H2O
+H2O