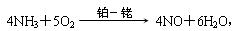题目内容
(1)将平均相对分子质量为7.2的N2和H2的混合气体5 mol充入容积固定为①工业上合成氨的生产条件是___________、___________、___________。
②该时间段用N2表示反应速率时v(N2)=___________mol/(L·min)。
③平衡时H2的转化率___________。
(2)等物质的量CaCO3和KHCO3组成的混合物?
①则生成CO2体积(标准状况)___________。
②若该
(1)①
(2)①
解析:(1)依![]() =7.2可算出n(N2)∶n(H2)=1∶4,则混合物中n(N2)=
=7.2可算出n(N2)∶n(H2)=1∶4,则混合物中n(N2)=![]() ×5=1 mol,n(H2)=
×5=1 mol,n(H2)=![]() ×5=4 mol。(2)CaCO3与KHCO3的摩尔质量都为
×5=4 mol。(2)CaCO3与KHCO3的摩尔质量都为![]() =0.16 mol,假设全部为KHCO3,由KHCO3—HCl—CO2知酸过量,产生CO2的物质的量为0.2 mol,则混合物与盐酸反应产生CO2的物质的量范围为0.16 mol<n(CO2)≤0.2 mol。
=0.16 mol,假设全部为KHCO3,由KHCO3—HCl—CO2知酸过量,产生CO2的物质的量为0.2 mol,则混合物与盐酸反应产生CO2的物质的量范围为0.16 mol<n(CO2)≤0.2 mol。
[当n(KHCO3)>0.1 mol且n(CaCO3)<0.1 mol,总耗酸量小于0.32 mol,故n(CO2)可等于0.2 mol。]

 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。