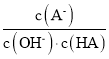题目内容
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 11gT2O含有的电子数为5NA
B. 常温下,0.2L 0.5molL﹣1NH4NO3溶液的氮原子数小于0.2NA
C. 含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA
D. 标准状况下,2.24L H2S全部溶于水所得溶液中HS﹣和S2﹣离子数之和为0.1NA
【答案】A
【解析】A、11g超重水的物质的量为![]() =0.5mol,而每个超重水分子中含10个电子,故0.5molT2O中含5NA个电子,故A正确;B、溶液中硝酸铵的物质的量n=0.5mol/L×0.2L=0.1mol,而1mol硝酸铵中含2mol氮原子,故溶液中含有的氮原子个数为0.2NA个,故B错误;C、二氧化锰只能和浓盐酸反应,和稀盐酸不反应,故当盐酸变稀时反应即停止,故盐酸不能反应完全,则转移的电子总数小于NA个,故C错误;D、H2S为弱酸,在溶液中不能完全电离,故溶液中的H2S、HS-和S2-的个数之和为0.1NA个,故D错误;故选A。
=0.5mol,而每个超重水分子中含10个电子,故0.5molT2O中含5NA个电子,故A正确;B、溶液中硝酸铵的物质的量n=0.5mol/L×0.2L=0.1mol,而1mol硝酸铵中含2mol氮原子,故溶液中含有的氮原子个数为0.2NA个,故B错误;C、二氧化锰只能和浓盐酸反应,和稀盐酸不反应,故当盐酸变稀时反应即停止,故盐酸不能反应完全,则转移的电子总数小于NA个,故C错误;D、H2S为弱酸,在溶液中不能完全电离,故溶液中的H2S、HS-和S2-的个数之和为0.1NA个,故D错误;故选A。

【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.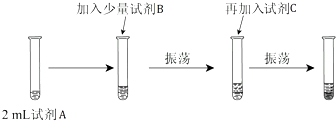
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .