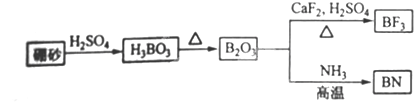
题目内容
已知下列晶体的熔点:NaCl:801℃ AlF3:1291℃ AlCl3:190℃ BCl3:107℃
刚玉Al2O3:2045℃ CO2:-56.6℃ SiO2:1723℃ 据此判断下列说法错误的是
刚玉Al2O3:2045℃ CO2:-56.6℃ SiO2:1723℃ 据此判断下列说法错误的是
| A.氧元素和铝组成的晶体中有的是原子晶体 |
| B.已给出的物质中只有BCl3和CO2是分子晶体 |
| C.同族元素的氧化物可以形成不同类型的晶体 |
| D.不同族元素的氧化物可以形成相同类型的晶体 |
B
根据氧化铝的熔点可知推测,氧元素和铝组成的晶体中有的可能是原子晶体,A正确。AlCl3、BCl3和CO2的熔点很低,属于分子晶体,B不正确。CO2和SiO2的晶体类型不同,C正确。氧化钠和氧化镁均是离子晶体,D正确。答案选B。

练习册系列答案
相关题目