题目内容
14.常温下,关于浓度相等的氢氧化钠和氨水,下列说法正确的是( )| A. | NH3•H2O溶液的c(OH-)>NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大 |
分析 浓度相等的氢氧化钠和氨水,氢氧化钠为强碱溶液中完全电离,一水合氨为弱碱存在电离平衡;
A.NH3•H2O溶液的c(OH-)小于NaOH溶液的c(OH-);
B.NH3•H2O在溶液中部分电离出铵根离子;
C.浓度相等,等体积的氢氧化钠和氨水溶液与足量盐酸完全反应,消耗HCl物质的量相同;
D.一水合氨为弱碱存在电离平衡,稀释促进水的电离.
解答 解:浓度相等的氢氧化钠和氨水,氢氧化钠为强碱溶液中完全电离,一水合氨为弱碱存在电离平衡;
A.一水合氨存在电离平衡,浓度相等的氢氧化钠和氨水,NH3•H2O部分电离,溶液中氢氧根离子浓度小于NH3•H2O的浓度,所以NH3•H2O溶液的c(OH-)小于NaOH溶液的c(OH-),故A错误;
B.浓度相等的氢氧化钠和氨水,NH3•H2O在溶液中部分电离出铵根离子,则氢氧化钠溶液中钠离子浓度大于氨水溶液中铵根离子浓度,即c(Na+)>c(NH4+),故B错误;
C.浓度相等,等体积的氢氧化钠和氨水溶液中溶质物质的量相同,与足量盐酸完全反应,消耗HCl物质的量相同,消耗的盐酸体积相同,故C错误;
D.一水合氨为弱碱存在电离平衡,稀释促进水的电离,将等体积的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡影响因素、溶液中离子浓度大小比较,题目难度中等,注意把握弱电解质的电离特点以及加水稀释对电离平衡的影响.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
13.下列液体均处于25℃,有关叙述中,正确的是( )
| A. | 某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水与盐酸等体积混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
2.某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列有关说法不正确的是( )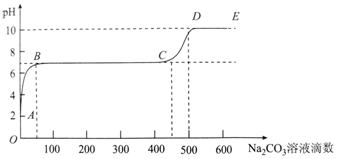

| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | AB发生的反应为:Ca2++CO32-═CaCO3↓ | |
| D. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) |
9.下图是常用的化学仪器,其中常用于物质的分离与提纯的是( )
| A. |  | B. |  | C. |  | D. |  |
19.-种制取粗碘的工艺流程如图所示,下列有关说法错误的是( )

| A. | 步骤②中的萃取过程为物理变化 | |
| B. | 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 | |
| C. | 步骤④所加的试剂X可能是稀硫酸 | |
| D. | 步骤⑤涉及的主要操作Y为分液和蒸馏 |
6.32.5gZn投入到VmL浓硫酸中,共热,恰好完全反应,则可以确定的数据是( )
| A. | 所得气体在标准状况下的体积 | B. | 所得气体的质量 | ||
| C. | 所得溶液的浓度 | D. | 原硫酸的浓度 |
3.有关于化学实验的操作或者说法中,正确的是( )
| A. | 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低 | |
| B. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| C. | 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
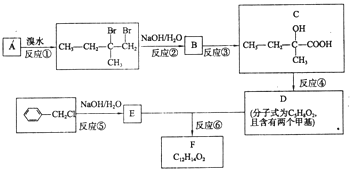 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线. .
.