题目内容
【题目】X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+的3d轨道中有9个电子。请回答下列问题:
(1)基态Y原子核外有___________种不同运动状态的电子;
Z所在周期中第一电离能最大的主族元素是____(写元素名称)。
(2)离子X Y-的立体构型是_____;,X2M2分子中X原子的杂化方式是______,1 molX2M2含有___________个σ键;
(3)向RZO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为_____色。反应过程中涉及的离子方程式为:______________________、__________________________。
(4) 从核外电子排布角度解释高温下R2O比RO更稳定的原因 _____________________________
(5)已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是_______________________________________________。
(6)如图表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见如图),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是____(填字母)。
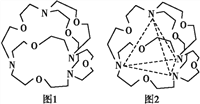
a.CF4 b.CH4 c.NH4+ d.H2O
【答案】 8 氯 V形 SP2 3 深蓝色 Cu2++2NH3·H2O=Cu(OH)2↓+2H2O Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- CuO中Cu2+的价电子为3d9,而Cu2O中Cu+的价电子为3d10,全满能量低更稳定 【答题空10】由于电负性F>N>H,NF3分子中共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+形成配合物。 c
【解析】X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体,则X是N,Y是O;X与氢元素可形成NH3;M是周期表中电负性最大的元素,M是F;Z基态原子的M层是K层电子数的3倍,Z是S;R2+的3d轨道中有9个电子,所以R是Cu,则
(1)Y为氧,核外电子数是8,所以基态氧原子核外有8种不同运动状态的电子;Z为硫,其所在周期第一电离能最大的主族元素为氯。(2)NO2-中N原子的价层电子对数是2+(5+1-2×2)/2=3,含有一对孤对电子,因此立体构型是V型;N2F2的结构式为F-N=N-F,氮原子含有一对孤对电子,所以N的杂化方式为sp2,1mol N2F2含有3molσ键。(3)铜离子能与氨气形成配位键,所以溶液颜色变为深蓝色,反应的方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2H2O、Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。(4)由于CuO中Cu2+的价电子为3d9,而Cu2O中Cu+的价电子为3d10,全满能量低更稳定,所以Cu2O比CuO更稳定;(5)由于由于电负性F>N>H,NF3分子中共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+形成配合物;(6)要想形成氢键就要掌握形成氢键的条件,一是要有氢原子,二是电负性比较强半径比较小的原子,如N,O,F才能形成分子间特殊的分子间作用力,符合这样的条件的有C与D,而题目要求形成四个氢键,因此只能选c。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案