题目内容
研究氧化还应常用到高锰酸钾,高锰酸钾是一种重要的化学试剂。为了增强其氧化性常将其酸化,但在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)高锰酸钾溶液保存的注意事项______________________________________________。
酸性溶液中高锰酸钾分解的离子方程式 _______________________________________。
(2)草酸可使酸性高锰酸钾溶掖褪色,请写出此反应的离子方程式______________________。
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
|
滴入 KMnO4 认溶液的次序(每滴溶液等体积) |
KMnO4 溶液紫色褪去的时间 |
|
先滴入第 1 滴 |
1min |
|
褪色后再滴入第 2 滴 |
15s |
|
褪色后再滴入第 3 滴 |
3s |
|
褪色后再滴入第 4 滴 |
1s |
请分析高锰酸钾溶液褪色时间变化的原因________________________________________。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠来标定高锰酸钾济液的浓度。他们准确称取2.680g纯净的草酸钠配成500mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4 溶液滴定。
①高锰酸钾溶液应装在______(填下途中的仪器编号)。
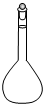
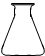

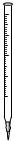
甲 乙 丙 丁
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定开始时,操作上必须是______________。
③当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为________________。
(附原子相对质量K=39Mn=55O=16 Na=23C=12)
(1)配成中性溶液并保存在棕色试剂瓶中避光保存;4MnO4-+4H+= MnO2+3O2↑+2H2O
(2) 2MnO4-+5H2C2O4+6H+= 2Mn2++10CO2↑+8H2O
(3)反应生成的Mn2+对反应又催化作用,且浓度大催化效果更好;
(4)①丙
② 逐滴滴入高锰酸钾溶液,待前一滴溶液褪色后再滴加,防止应反应不及时导致分解;
③0.0200mol/L
【解析】
试题分析:(1)在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。所以保存高锰酸钾应配成中性溶液并保存在棕色试剂瓶中避光保存;4MnO4-+4H+= MnO2+3O2↑+2H2O
(2)2MnO4-+5H2C2O4+6H+= 2Mn2++10CO2↑+8H2O
(3)反应体系温度不变,但反应速率加快,故是反应产生催化剂所致,反应生成的Mn2+对反应又催化作用,且浓度大催化效果更好;(4)高锰酸钾溶液为氧化性溶液,应盛放在酸性滴定管中;逐滴滴入高锰酸钾溶液,待前一滴溶液褪色后再滴加,防止应反应不及时导致分解;
考点:考查氧化还原反应滴定有关问题。

| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | … |
(1)在铝热反应中金属铝表现出
①Fe ②Cr(铬) ③V(钒) ④Ca ⑤Mn
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色未变血红色,即可证明熔融物中不含有Fe2O3.则
①物质甲是
②该同学的实验方案是否合理?