题目内容
某同学用质量分数为98%、密度为1.84 g/cm3的浓硫酸,配制100 mL 2 mol/L H2SO4溶液,并进行有关的实验。试回答下列问题:
(1)计算所需浓硫酸的体积。
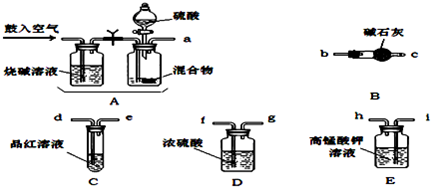
(2)从下列仪器中选出实验所需要的仪器 (填序号)。
A.10 mL量筒 B.20 mL量筒 C.100 mL烧杯 D.100 mL容量瓶
E.托盘天平 F.分液漏斗 G.玻璃棒 I.胶头滴管
(3)该同学为测定某碳酸钠样品的纯度,取2.5 g该碳酸钠样品,加入足量上述稀硫酸。碳酸钠完全反应(杂质不反应),生成二氧化碳气体448mL(标准状况)。求该碳酸钠样品中Na2CO3的质量分数。
【答案】
(1)10.9mL(3分)
(2)B、C、D、G、I(各1分,共5分)
(3)84.8%(2分)
【解析】(1)稀释过程中溶质的质量是不变的,所以浓硫酸的体积是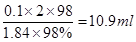 。
。
(2)根据浓硫酸的体积可知,严格选择2ml量筒。稀释需要烧杯和玻璃棒,转移需要容量瓶和胶头滴管,所以答案选B、C、D、G、I。
(3)反应的方程式为 Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106g 22.4L
m 0.448L
所以m=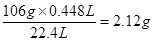
碳酸钠样品中Na2CO3的质量分数为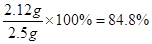

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目