题目内容
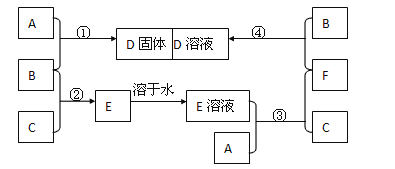
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)写出F、G的化学式:F.________;G._______。
(2)检验D中阳离子的方法为_____________________________________________________
(3)保存C溶液时要加固体A的原因是_____________________________________________
(4)写出下列转化的离子方程式:
①B→C:______________________________________________________________________
②C→D:______________________________________________________________________
③E→F:___________________________________________________________________________
【答案】 Fe(OH)3 Fe2O3 取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+ 防止Fe2+被O2氧化 Fe3O4 +8H+ == Fe2+ +2 Fe3+ + 4H2O 2Fe2++Cl2 == 2Fe2++2Cl- 4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
【解析】本题主要考查氯化铁等铁的化合物的性质。
(1)F是氢氧化铁,G是氢氧化铁分解产生的氧化铁,F、G的化学式:F. Fe(OH)3;G. Fe2O3。
(2)检验D中阳离子Fe3+的方法为取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+。
(3)A是铁,C是氯化亚铁,保存C溶液时要加固体A的原因是防止Fe2+被O2氧化。
(4)下列转化的离子方程式:
①B是四氧化三铁,B→C:Fe3O4+8H+== Fe2++2 Fe3++ 4H2O。
②D是氯化铁,C→D:2Fe2++Cl2 == 2Fe2++2Cl-。
③E是氢氧化铁,E→F:4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3。