题目内容
【题目】H、C、N、O都属于自然界中常见的非金属元素。
(1)O、C、N三种元素的第一电离能最大的元素的基态原子价电子的轨道表达式(即电子排布图)为 ,p轨道按该排列的原理是 。
(2) O22+与N2互为等电子体,则O22+中![]() 键数目和
键数目和![]() 键数目之比为 。
键数目之比为 。
(3)N元素常形成两种含氧酸,NO2-中N原子的杂化类型是 ;NO2-的空间构型是 ,硝酸沸点不高的原因可能是 。(简答两条)
(4)Co2+在水溶液中以[Co(H2O)6]2+形式存在,向含Co2+的溶液中加入氨水,可生成[Co(NH3)6]2+,[Co(NH3)6]2+更稳定的原因是 。
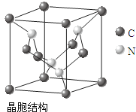
(5)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,则该晶体为___________晶体,若晶胞边长为acm,则该晶体的密度为 g/cm3(只需列算式,不必计算出数值,阿伏伽德罗常数的值为NA)。
【答案】
(1)![]() ;洪特规则;
;洪特规则;
(2)1:2 ;
(3)sp2;V形;HNO3是分子晶体,易形成分子内氢键;
(4)N的电负性小于O,更易提供孤对电子形成配位键;
(5)原子;92/a3NA
【解析】
试题分析:(1) 同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;电离能最大的元素为N,基态原子价电子的轨道表达式为![]() ,p轨道按该排列的原理洪特规则,故答案为:
,p轨道按该排列的原理洪特规则,故答案为:![]() ;洪特规则;
;洪特规则;
(2) O22+与N2互为等电子体,则O22+中含有1个![]() 键和2个
键和2个![]() 键,数目之比为1:2,故答案为:1:2;
键,数目之比为1:2,故答案为:1:2;
(3) NO2-中N原子的价层电子对数=2+![]() (5+1-2×2)=3,杂化类型是sp2,含有1个孤电子对,NO2-的空间构型是V型;HNO3是分子晶体,易形成分子内氢键,使沸点降低,故答案为:sp2;V形;HNO3是分子晶体,易形成分子内氢键;
(5+1-2×2)=3,杂化类型是sp2,含有1个孤电子对,NO2-的空间构型是V型;HNO3是分子晶体,易形成分子内氢键,使沸点降低,故答案为:sp2;V形;HNO3是分子晶体,易形成分子内氢键;
(4) N的电负性小于O,更易提供孤对电子形成配位键,因此向含Co2+的溶液中加入氨水,可生成[Co(NH3)6]2+,故答案为:N的电负性小于O,更易提供孤对电子形成配位键;
(5)根据该晶体硬度超过目前世界上最硬的金刚石,可知该晶体为原子晶体;该晶体晶胞中含有C原子8×![]() +4×
+4×![]() =3,N原子数为4,化学式为C3N4,1mol晶体的质量为92g,1mol晶胞的体积为NA a3cm3,因此该晶体的密度为
=3,N原子数为4,化学式为C3N4,1mol晶体的质量为92g,1mol晶胞的体积为NA a3cm3,因此该晶体的密度为![]() =
=![]() g/cm3,故答案为:原子;
g/cm3,故答案为:原子;![]() 。
。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案