题目内容
已知25 ℃时KW=10-14,如果100 ℃时KW=5.5×10-13,这说明( )
| A.100 ℃时水的电离程度较小 |
| B.前者c(H+)较后者大 |
| C.水的电离过程是一个吸热过程 |
| D.100 ℃时0.1 mol·L-1 DCl的重水溶液中水的电离程度一定是室温时电离程度的10倍 |
C
解析

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
下列溶液一定显酸性的是
| A.含H+的溶液 |
| B.c(OH-)<c(H+)的溶液 |
| C.pH<7的溶液 |
| D.能与金属Al反应放出H2的溶液 |
下列各步制取物质,最终无法达到目的的有( )
A.Al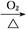 Al2O3 Al2O3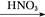 Al(NO3)3 Al(NO3)3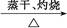 Al2O3 Al2O3 |
B.Cu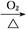 CuO CuO CuSO4溶液 CuSO4溶液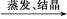 CuSO4·5H2O CuSO4·5H2O |
C.Fe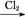 FeCl3 FeCl3 Fe(OH)3 Fe(OH)3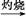 Fe2O3 Fe2O3 |
D.FeSO4溶液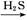 FeS FeS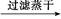 FeS FeS |
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅
黄色沉淀。对上述过程,下列理解或解释中正确的是( )
| A.Ksp(AgCl)<Ksp(AgBr) |
| B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀 |
| C.上述实验说明AgCl没有NaBr稳定 |
| D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解 |
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
| A.溶液中所有离子的浓度都减小 |
| B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 |
| D.溶液的pH增大 |
室温下,某溶液中由水电离产生的c(H+)等于10-13 mol·L-1,该溶液的溶质不可能是( )
| A.NaHSO4 | B.NaCl | C.HCl | D.Ba(OH)2 |
下列关于强、弱电解质的叙述中正确的是( )
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离 |
| D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4
 2H++S
2H++SD.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱