题目内容
室温下,某浓度的醋酸溶液中n(CH3COO-)=0.01mol,下列叙述正确的是
| A.向该醋酸溶液中加入等体积等浓度的盐酸,抑制醋酸的电离,溶液中c(H+)增大 |
| B.若醋酸溶液体积为1L,则c(CH3COOH)=0.01mol/L |
| C.与NaOH恰好中和时,溶液中c(Na+)<c(CH3COO-) |
| D.与等体积等浓度的醋酸钠溶液混合,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-) |
AD
试题分析:醋酸是弱酸,盐酸是强酸,前者部分电离,后者完全电离,加入等浓度盐酸,增大溶液中氢离子浓度,使CH3OOH
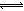 CH3COO—+H+的平衡左移,故A选项正确;由于n(CH3COO-)=0.01mol,说明已经电离的醋酸为0.01mol,则未电离的醋酸远远大于0.01mol,若醋酸溶液体积为1L,则c(CH3COOH)>0.01mol/L,故B选项错误;醋酸与氢氧化钠恰好中和时,溶液中的溶质只有醋酸钠,CH3OONa="=" CH3COO—+Na+,由于钠离子不能水解,醋酸根离子部分水解,则溶液中c(Na+)>c(CH3COO-),故C选项错误;混合溶液呈电中性,含有钠离子、氢离子、氢氧根离子和醋酸根离子,根据电荷守恒原理,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),故D选项正确。
CH3COO—+H+的平衡左移,故A选项正确;由于n(CH3COO-)=0.01mol,说明已经电离的醋酸为0.01mol,则未电离的醋酸远远大于0.01mol,若醋酸溶液体积为1L,则c(CH3COOH)>0.01mol/L,故B选项错误;醋酸与氢氧化钠恰好中和时,溶液中的溶质只有醋酸钠,CH3OONa="=" CH3COO—+Na+,由于钠离子不能水解,醋酸根离子部分水解,则溶液中c(Na+)>c(CH3COO-),故C选项错误;混合溶液呈电中性,含有钠离子、氢离子、氢氧根离子和醋酸根离子,根据电荷守恒原理,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),故D选项正确。
练习册系列答案
相关题目

