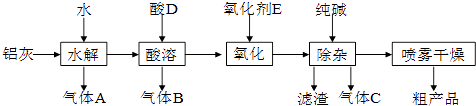
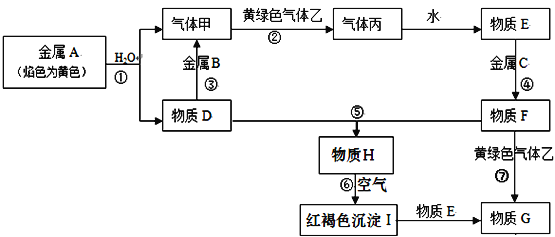
��Ŀ����
����Ŀ����֪�������������·����ķ�ӦΪAsO43��+2I��+2H+�TAsO33��+I2+H2O���ڼ��������·� ���ķ�ӦΪAsO33��+I2+2OH���TAsO43��+H2O+2I�� �� �����ͼװ�ã�C1��C2��Ϊʯī�缫�����ֱ�������������� ����B�ձ�����μ���Ũ���ᣬ���ֵ�����ָ�뷢��ƫת
��������B�ձ�����μ���40% NaOH��Һ ���ֵ�����ָ��ƫת��������෴�� �Իش��������⣺
��1�����β���������ָ��ƫת����Ϊʲô�෴�����û�ѧƽ���ƶ�ԭ������ ��
��2�������������C1��Ϊ���������ĵ缫��ӦΪ ��
��3�������������C2��Ϊ���������ĵ缫��ӦΪ �� 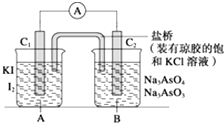
���𰸡�
��1����������ᣬc��H+������AsO43���õ��ӣ�I�� ʧ���ӣ�����C1�Ǹ�����C2��������������Ӽc��OH��������AsO33��ʧ���ӣ�I2�õ��ӣ���ʱ��C1��������C2�Ǹ������ʷ����� ͬ����ķ�Ӧ������ת�Ʒ���ͬ����������ָ��ƫת����ͬ
��2������2I����2e��=I2
��3������AsO33��+2OH����2e��=AsO43��+H2O
���������⣺��ͼ��֪����װ��Ϊԭ��أ�����AsO43��+2I��+2H+=AsO33��+I2+H2O��C1��Ϊ�������缫��Ӧ����2I����2e��=I2������AsO33��+I2+2OH��=AsO43��+2I��+H2O��C2��Ϊ�����������ɸ���������������1�������β������̾����γ�ԭ��أ����ǰѻ�ѧ��ת��Ϊ���ܣ��γɵ���ָ��ƫת�����1��C1�Ǹ�����C2������������2��C1��������C2�Ǹ����������ɸ���������������ָ��ƫת����ͬ�� ���Դ��ǣ���������ᣬc��H+������AsO43���õ��ӣ�I�� ʧ���ӣ�����C1�Ǹ�����C2��������������Ӽc��OH��������AsO33��ʧ���ӣ�I2�õ��ӣ���ʱ��C1��������C2�Ǹ������ʷ����� ͬ����ķ�Ӧ������ת�Ʒ���ͬ����������ָ��ƫת����ͬ����2��C1��Ϊ�������缫��Ӧ����2I����2e��=I2 �� ���Դ��ǣ�����2I����2e��=I2�� ��3��C2��Ϊ�������缫��ӦΪAsO33��+2OH����2e��=AsO43��+H2O�����Դ��ǣ�����AsO33��+2OH����2e��=AsO43��+H2O��

����Ŀ�������ijָʾ����һ��pH��Χ������ʾ����ɫ�������������ָʾ����ϡ�����У���������������Һ�����ֵ���ɫ�仯�����ǣ� ��
��ɫ | �� | �� | �� | �� | �� |
PH��Χ | 1��3 | 4��5 | 6��7 | 8��11 | 11��14 |
A.�ɺ����
B.��������
C.���̱��
D.��������