题目内容
近来报道,含镍烤瓷牙可能导致人体出现不良反应。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知氧化性:Fe2+<Ni2+<Cu2+),下列叙述正确的是
| A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni |
| B.电解后,电解槽底部的阳极泥中只有Cu和Pt |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.电解过程中,阳极质量的减少与阴极质量的增加相等 |
B
根据电解原理及放电顺序可知:
阳极(粗镍):Ni—2e-=Ni2+(主要)、Fe—2e-=Fe2+、Zn—2e-=Zn2+
阴极(纯镍):Ni2++2e-===Ni
阳极材料失电子,发生氧化反应,不活泼金属Cu和Pt不会参加反应,作为阳极泥沉落在电解槽底部,溶液中存在的阳离子主要有有Ni2+,还含有少量的Fe2+、Zn2+;
由于阳极除镍外还有杂质金属溶解,而阴极只有镍离子得电子使阴极质量增加,故阳极质量的减少与阴极质量的增加并不相等
故答案为B
阳极(粗镍):Ni—2e-=Ni2+(主要)、Fe—2e-=Fe2+、Zn—2e-=Zn2+
阴极(纯镍):Ni2++2e-===Ni
阳极材料失电子,发生氧化反应,不活泼金属Cu和Pt不会参加反应,作为阳极泥沉落在电解槽底部,溶液中存在的阳离子主要有有Ni2+,还含有少量的Fe2+、Zn2+;
由于阳极除镍外还有杂质金属溶解,而阴极只有镍离子得电子使阴极质量增加,故阳极质量的减少与阴极质量的增加并不相等
故答案为B

练习册系列答案
相关题目
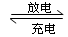 2PbSO4(s) + 2H2O(l);下列说法正确的是 ( )
2PbSO4(s) + 2H2O(l);下列说法正确的是 ( ) Na2Sx,下列说法中正确的是
Na2Sx,下列说法中正确的是