题目内容
某卤素X2与热的浓NaOH溶液反应,生成A,B两种盐,往A盐的浓溶液中加入一定量的另一种卤素Y2的水溶液,又可生成X2,且X2不能使淀粉溶液变蓝,则X2,Y2只能是
[ ]
A.Cl2,I2
B.Br2,Cl2
C.Cl2,Br2
D.Cl2,Br2
答案:B
解析:
提示:
解析:
|
此题有三条线索:一是X2能在强碱溶液中发生歧化反应,生成两种盐,X2不是F2;二是Y2能把X-氧化(即Y2能置换出X2),说明Y2比X2活泼;三是X2不是I2. |
提示:
|
如果掌握了卤素的非金属性的强弱顺序以及F2和I2的特殊性,这个问题就可迎刃而解,无关的选择项A,C,D就可排除. |

练习册系列答案
相关题目


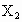 与热的浓NaOH溶液反应生成A和B两种盐,若在A盐溶液中加入另一种卤素
与热的浓NaOH溶液反应生成A和B两种盐,若在A盐溶液中加入另一种卤素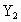 的水溶液,又可生成
的水溶液,又可生成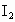 、
、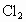
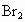 、
、