题目内容
【题目】【成都市2017届第二次模拟考试】前四周期元素A、B、C、D、E的原子序数依次增大,A的质子数等于周期数,B与C的 P轨道均有三个成单电子,D的最高正价与最低负价代数和为4,E的最外层只有一个电子, 内层轨道处于全充满状态。试回答下列问题。
(1)基态E原子的电子排布式为_________;C和D的第一电离能较大的________(填元素符号)。
(2)DO32-中D原子的杂化类型为_________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有_____________。
(3)结构式为A—B=B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等离子体,则NO+的电子式为___________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为______;产物中阳离子的配体是______(填化学式)。
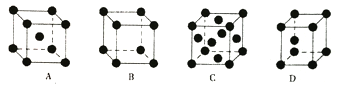
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516Pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知![]() =1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。
=1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。

【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 P sp2 氢键、范徳华力、共价键 3∶1
![]() CuSO4+4 NH3·H2O ==[Cu(NH3)4]SO4+4 H2O NH3 223.4 两种晶体中离子的配位数不同。由于r(O2-) < r(S2-),r+ /r-的值增大,晶体中离子的配位数由4增至6,导致晶体堆积方式不同。
CuSO4+4 NH3·H2O ==[Cu(NH3)4]SO4+4 H2O NH3 223.4 两种晶体中离子的配位数不同。由于r(O2-) < r(S2-),r+ /r-的值增大,晶体中离子的配位数由4增至6,导致晶体堆积方式不同。
【解析】本题考查选修三《物质结构与性质》,A的质子数等于周期数,则A为H,B与C的p轨道均有三个成单电子,说明B和C属于同主族,即分别属于N和P,D的最高正价与最低负价的代数和为4,则D为S,E的最外层只有一个电子,且内层全充满,因此E为Cu, (1)Cu位于第四周期第IB族,因此电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1 ;P和S属于同周期,同周期第一电离能从左向右增强,但IIA>IIIA、VA>VIA,因此第一电离能P>S;(2)DO32-为SO32-,其中S有3个σ键,孤电子对数为(6+2-3×2)/2=1,价层电子对数为4,即SO32-中S的杂化类型为sp3;组成的化合物是H2SO4,含有的作用力是共价键、范德华力、氢键;(3)成键原子之间只能有1个σ键,双键中有1个π键,因此H-N=N-H中σ键和π键的比值为3:1;等电子体的结构相似,N2的结构式为![]() ,因此NO+的电子式为
,因此NO+的电子式为![]() ;(4)EDO4的化学式为CuSO4,与过量的氨水发生络合反应,反应方程式为:CuSO4+4NH3·H2O=[Cu(NH3)4]SO4+4H2O,Cu2+提供空轨道,NH3提供孤电子对,因此NH3是配体;(5)根据晶胞的结构,黑球和白球之间最近的距离是体对角线的1/4,即为
;(4)EDO4的化学式为CuSO4,与过量的氨水发生络合反应,反应方程式为:CuSO4+4NH3·H2O=[Cu(NH3)4]SO4+4H2O,Cu2+提供空轨道,NH3提供孤电子对,因此NH3是配体;(5)根据晶胞的结构,黑球和白球之间最近的距离是体对角线的1/4,即为![]() (a为晶胞的边长),代入数值,解得为223.4pm,两种晶体中离子的配位数不同。由于r(O2-)<r(S2-),r+/r-的值增大,晶体中离子的配位数由4增至6,导致晶体堆积方式不同。
(a为晶胞的边长),代入数值,解得为223.4pm,两种晶体中离子的配位数不同。由于r(O2-)<r(S2-),r+/r-的值增大,晶体中离子的配位数由4增至6,导致晶体堆积方式不同。

 名校课堂系列答案
名校课堂系列答案